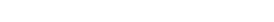İÇİNDEKİLER
- Önsöz
- Giriş
- Biyoteknolojik İlaçlar ve Üretim Süreçleri
- Biyobenzer İlaçlar ve Karşılaştırılabilirlik
- Biyobenzer Ürünlerde Ekstrapolasyon
- Biyobenzer İlaçlarda Değiştirilebilirlik
- Biyoüstünler
- Referans Ürünle Yeterli Karşılaştırma Çalışması Olmayan Biyolojik Ürünler
- Biyolojik ve Biyobenzer İlaçlarda Farmakovijilans, İzlenebilirlik ve Risk Yönetimi
- Yazarlar
BİYOBENZER İLAÇLARDA KLİNİK ÇALIŞMALAR VE KARŞILAŞTIRILABİLİRLİK
Yirminci yüzyılın sonlarında biyoteknoloji alanındaki gelişmeler sonucunda üretilen çok sayıda rekombinant protein klinik kullanıma girmiştir.
Rekombinant terapötik proteinler E. Coli’den, bitki ve hayvan hücre sistemlerine kadar değişen farklı hücre sistemlerinde fermantasyon yöntemiyle üretilir. Bu rekombinant terapötik proteinlerin moleküler yapıları oldukça karışıktır. Aynıları başka bir üretici tarafından başka bir üretim süreciyle üretilmeye çalışıldığında primer yapıları (amino asit dizileri) birebir aynı olsa da primer yapının maruz kaldığı modifikasyonlarla (-posttranslasyonel- modifikasyon) bu ürünlerin ikincil, üçüncül ve dördüncül yapıları kaçınılmaz olarak farklılaşmaktadır (1,2). Başka bir deyişle asetilasyon, fosforilasyon ve metilasyon gibi posttranslasyonel modifikasyonlar; üç boyutlu şekillenmeler, kıvrılmalar ve alt birimlerin etkileşimi gibi yapısal farklılıklarla beraber birçok fizikokimyasal ve biyolojik özellikleri de farklılaştırmaktadır. Tüm bu farklılıklar farmakokinetik (FK), farmakodinamik (FD), etkililik ve güvenlilik sonuçlarını etkileyebilmektedir. Bununla birlikte, biyoterapötik proteinlerin biyobenzerlerinin geliştirilmesi sürecinde referans ürünün detaylı karakterizasyonuyla birlikte, biyobenzer ürünün yüksek benzerliğinin sağlanması FK, FD, etkililik ve güvenlilik açısından iki ilacın benzer olacağının önemli bir göstergesidir. Bu çerçevede biyobenzer ürünün erken geliştirme süreci en kritik aşamaları kapsamaktadır. Bu süreçlerdeki eksiklikler sonraki aşamalarda değiştirilemez ya da kompanse edilemez. Gerek FK Faz I çalışmalar, gerek Faz III çalışmalar iki apayrı ilacı karşılaştırmaktan ziyade biyobenzer ürünle referans ürün arasındaki rezidüel belirsizlikleri değerlendirmek için yapılmaktadır. Biyobenzer ilaçların etkililik ve güvenliliğini değerlendirmek için yapılan klinik çalışmalar diğer klinik çalışmalardan farklı olan yeni yöntemler değildir. Biyobenzerlere dair klinik çalışmaların temel farkı yeni bir etkililik ve güvenlilik verisi ortaya çıkarmak yerine referans ürüne benzerliğini göstermektir (2,3). Başka bir deyişle biyobenzer klinik çalışmalar benzerliği göstermek üzere yoğunlaşan ve tasarlanan çalışmalardır. Bu çalışmalar benzerlik ve karşılaştırılabilirlik tartışmalarının nihai sonucu açısından tek başına bir temel zemin değildir.
Biyobenzerlik değerlendirmeleri kanıtların toplamı (totality of evidence for biosimilars) göz önünde bulundurularak yapılmalıdır (2-4).

Şekil 1. Biyobenzer ilaç ile referans ilaç arasında kaçınılmaz yapısal farklılıkların etkililik ve güvenlilik açısından fark yaratıp yaratmadığını test etmek için klinik çalışmalara ihtiyaç vardır. Faz I FK bulgular ve Faz III çalışmalarla benzerlik / denklik test edilir. Yeni ilaç geliştirme sürecinde yapılan Faz II ön etkililik çalışmaları benzerlik değerlendirmesine katkı sağlamayacağı için yapılmaz.
FAZ I FARMAKOKİNETİK VE FARMAKODİNAMİK
Farmakokinetik (FK) vücudun ilaç üzerine etkilerini, farmakodinamik (FD) ise ilacın vücut üzerine etkilerini incelemektedir. Dolayısıyla erken faz çalışmalarda FK ve FD performansı, ilaçların nihai kullanımı açısından en kritik aşamalardandır.
FK ve FD ölçümler klinik sonuçlarla ilişkili etkililik göstergelerini içermelidir. FK ve FD ölçümler klinik etkililiğin göstergeleri olacağı için yeterince duyarlı, güvenilir ve net olmalıdır. Bu özellikteki değerlendirmelerle biyobenzerlerin Faz I çalışmalarında FK ve FD performansı vücudun ilaca ve ilacın vücuda etkisini değerlendirdiğinden, hem Faz III çalışmalar için ön yeterlilik hem de Faz III çalışmaların sonucu için ön göstergedir (3-5).
Posttranslasyonel modifikasyonlar ve üretim sürecindeki diğer tüm işlemlere bağlı olarak farklılıklar içermesi kaçınılmaz olan bir biyobenzerin, klinik kullanımda referans ilaçla benzer klinik etkililik göstermesinin ön koşulu, insanda referans ilaca benzer FK ve FD özelliklere sahip olduğunun gösterilmesidir. Bu nedenle karşılaştırmalı insan FK/FD Faz I çalışmaları genel olarak biyobenzerliği göstermeyi destekleyen temel bileşenler olarak kabul edilir. Bu çalışmalara gerek duyulmayacağına dair bilimsel gerekçe sağlanamadığı sürece biyobenzerliği kanıtlamak için Faz I çalışmaların yapılması zorunludur (7-10).
Gönüllüler
Biyobenzerler ile referans ürünün karşılaştırıldığı klinik farmakoloji çalışmaları biyobenzer ile referans ürün arasındaki farkı en uygun şekilde gösterecek sağlıklı ya da hasta gönüllülerde yapılabilir (2,4,5). Bazen immünojenisitenin etkisinin daha açık gözlenebileceği sağlıklı gönüllüler uygunken, bazen de uygulanacak ilaçların (özellikle onkoloji alanında birçok monoklonal antikor) sağlıklı gönüllülerde kabul edilemez etkilerinden dolayı hasta gönüllüler çalışmalara dahil edilir. Bununla beraber hastalık veya eş zamanlı kullanımı zorunlu ilaç varlığı, FK sonuçları etkilemekteyse ve araştırılan ilacın bu durumlarda kullanım zorunluluğu varsa yine hasta gönüllüler çalışmaya dahil edilir (5).
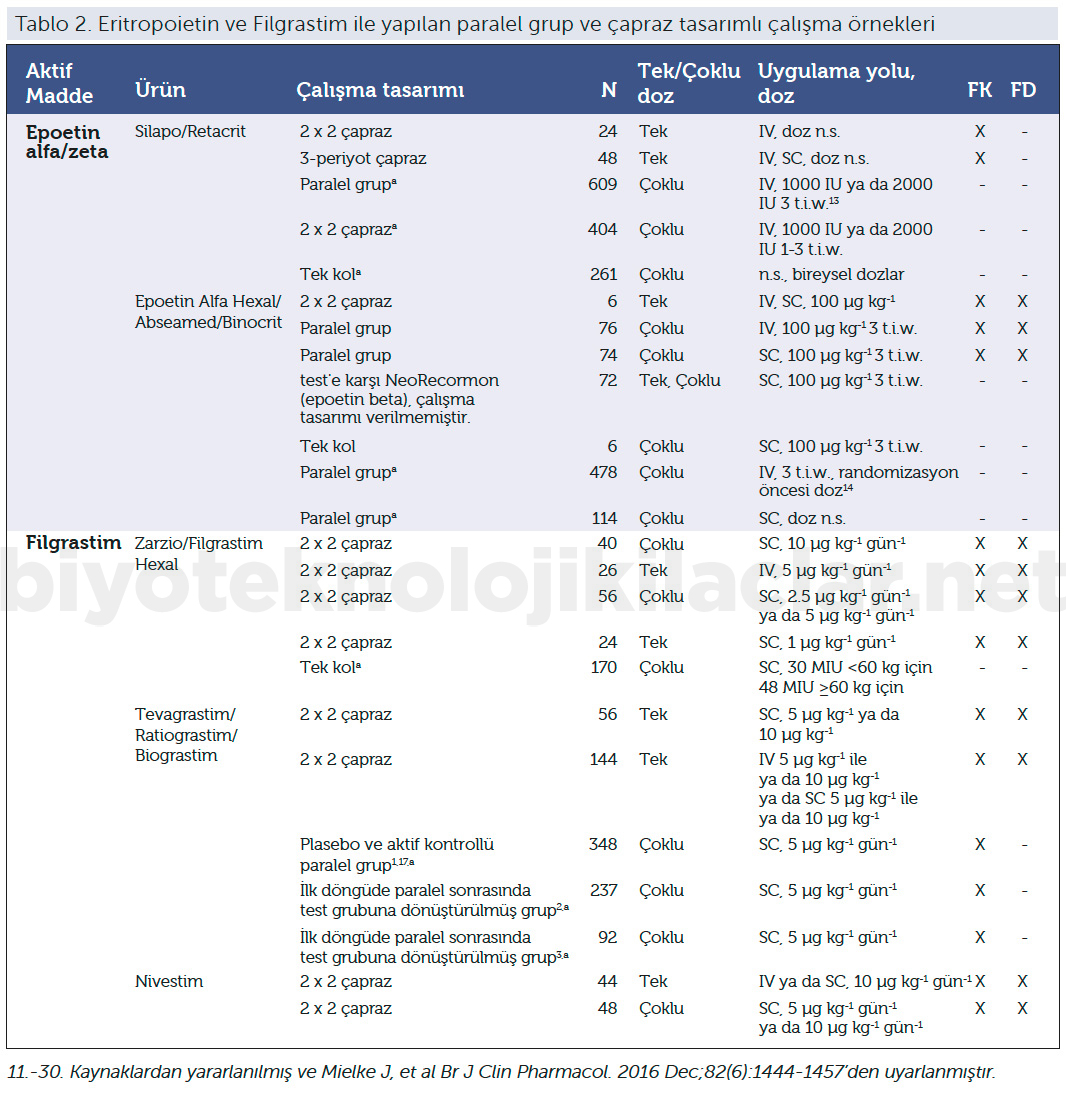
Tablo 1’de görüldüğü üzere zaman zaman aynı referans ürünün biyobenzer çalışmalarında farklı üreticiler, sağlıklı ya da hasta gönüllüleri çalışmaya dahil edebilmektedir. Çalışmaya dahil edilen popülasyonun seçiminin yeterli bilimsel gerekçelerle ortaya konması asıl önemli noktadır. Örneğin insülin glarjin için referans ve biyobenzer ürün ile yapılan çalışmada olduğu gibi sağlıklı gönüllüler ve hasta gönüllüler çalışmaya dahil edilebilmektedir. Biyobenzer ürün ile yapılan çalışmada 211 sağlıklı gönüllünün yanında, European Medicines Agency’s (EMA) Committee for Medicinal Products for Human Use (CHMP) talebi üzerine 20 tip I diyabetli hasta, çalışmaya dahil edilmiştir.
Örneklem Büyüklüğü
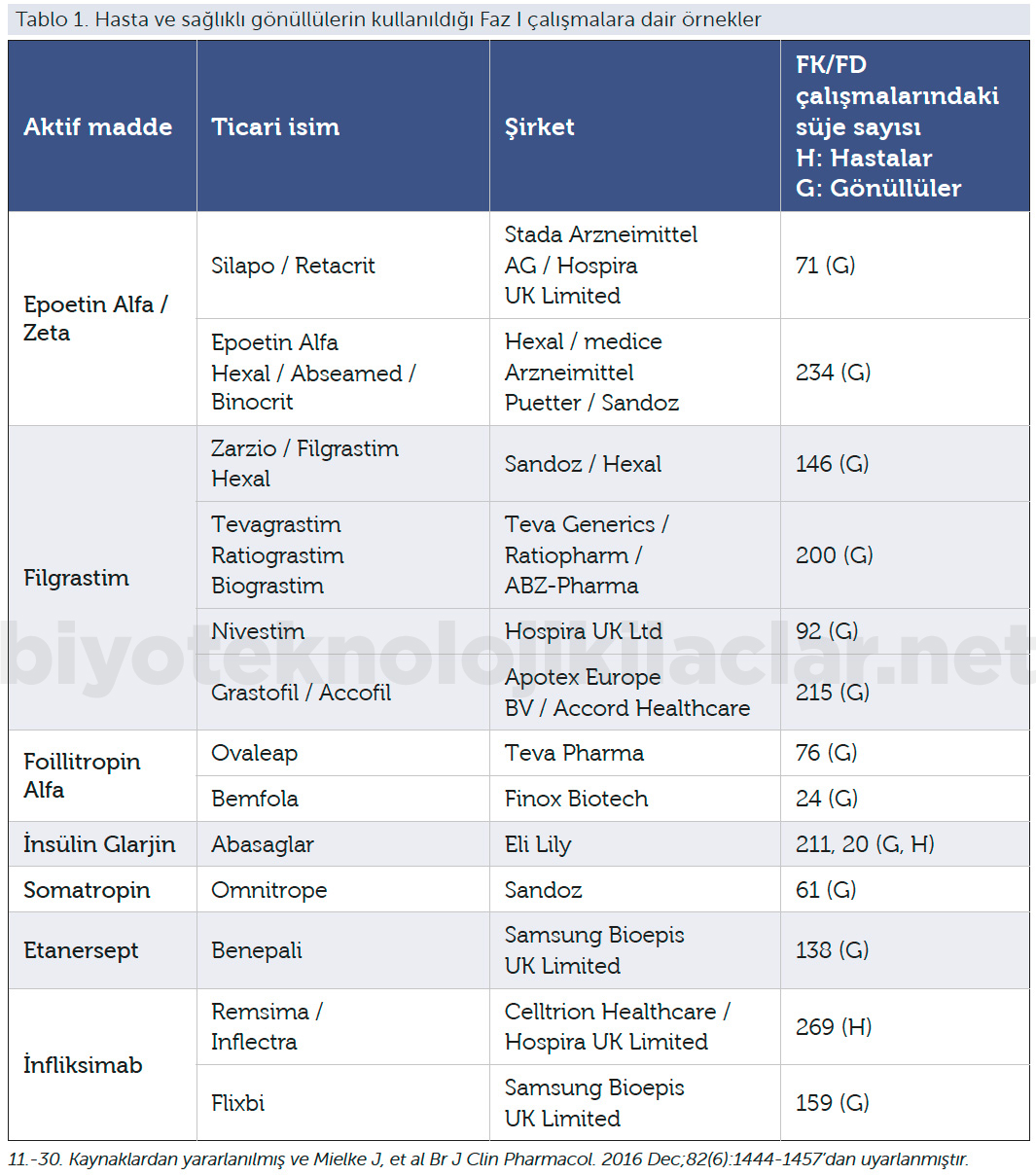
FK çalışmalarda örneklem büyüklüğü primer sonlanım noktalarında %80–125’lik bir aralıkta %90 güvenlik aralığında “equivalance” gösterecek şekilde hesaplanır. Örneklem büyüklüğü de bu gereklilikleri karşılayacak sayıda olmalıdır. Eğer Faz I çalışmada endikasyona konu olacak FD bir değerlendirme de yapılacaksa FK sonlanım noktalarına ek olarak co-primary (eş birincil sonlanım noktası) FD sonlanım noktası veya diğer sonlanım noktaları da örneklem büyüklüğüne etki edebilir (2,4). Bu çalışmalarda en kritik noktalardan biri de birçok rekombinant terapötik proteinin hem Avrupa hem de Amerika üretimi olduğu için karşılaştırmalar referans ürünün Avrupa ve Amerika’da üretilen serileriyle yapılmaktadır. Bu yaklaşımla Faz III çalışmada kullanılacak referans ürünün üretim yerine bağlı tartışma soruları da karşılanmış olur. Bu nedenle karşılaştırma grubu sayısı ve dolaylı olarak çalışmaya dahil edilen gönüllü sayısı artmış olur (31-32).
Şekil 2. Farklı kıtalarda üretimi olan aynı referans ürünün FK çalışma örneği (intravenöz uygulama). Biyobenzer üretim ve farklı kıtalarda üretilen aynı referans ürün formlarının denk özellikler göstermesi beklenir. Bu tasarımlar dolaylı olarak referans ürünün farklı üretim yerlerinde üretilmesi kaynaklı ortaya çıkabilecek soruları da karşılamış olmaktadır.
Çalışma Tasarımı
Bu çalışmalarda paralel grup ve çapraz (crossover) tasarımlar kullanılabilir. Bununla beraber, çapraz tasarımlarda gruplarda kullanılan ilaçlar için bir arınma (washout) süresine ihtiyaç vardır (Şekil 3). Yarılanma ömrü çok uzun olan biyoterapötik ürünlerin biyobenzer çalışmalarında arınma süreleri haftalar ve aylar alabilir. Birçok hastalıkta bu bekleme süreleri tedavi süreci için kabul edilemez ve çapraz çalışma tasarımı yapılamaz (2,4).
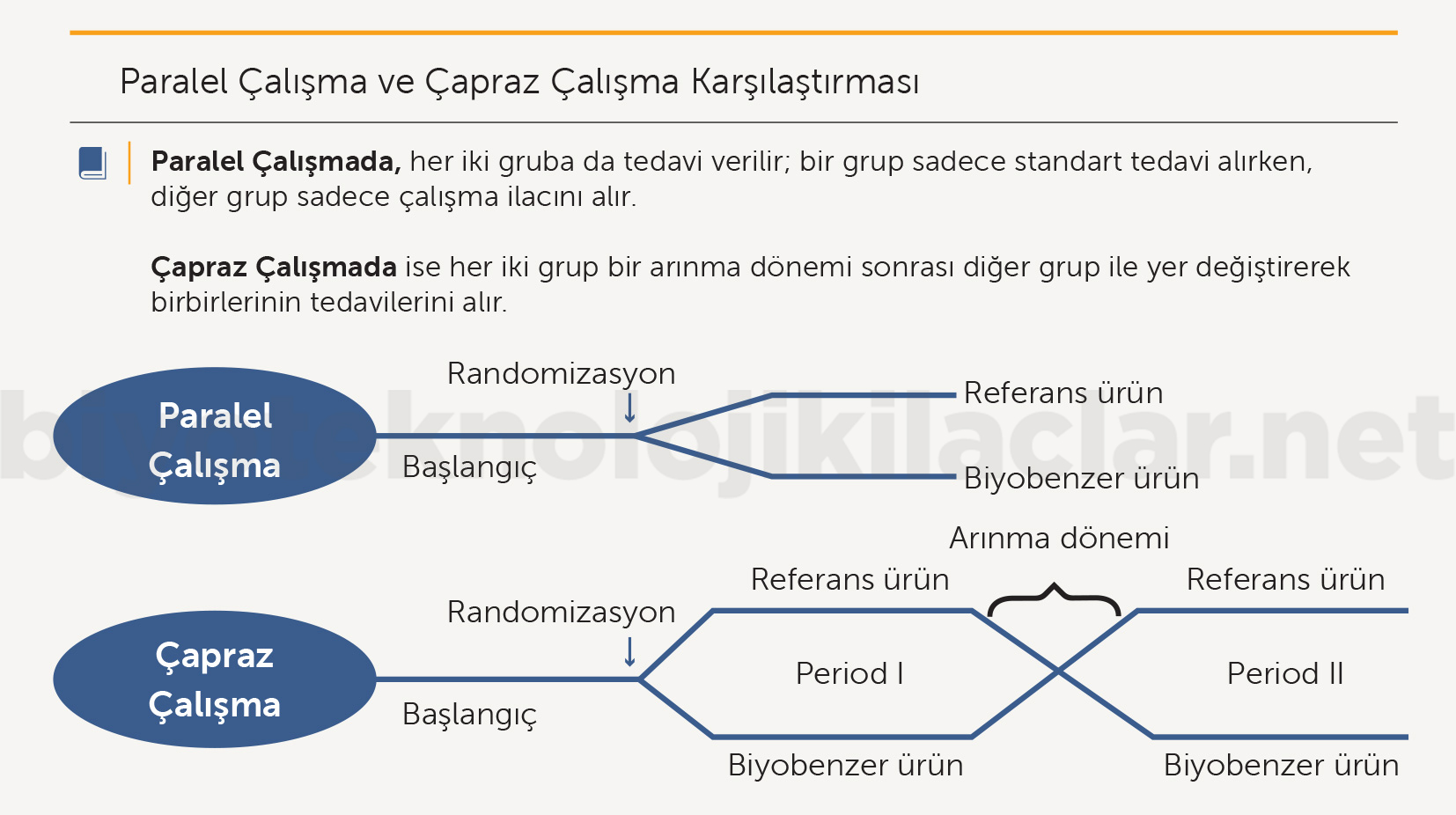
Şekil 3. FK çalışma tasarımları
Çapraz tasarımlı çalışmalarda çapraz geçiş tek doz veya çoklu doz sonrası olabilmektedir (Tablo 2).
Sonlanım Noktaları
Faz I FK çalışmalarda birincil sonlanım noktaları genellikle maksimum serum konsantrasyonu (Cmax), ilk ilaç uygulama zamanından son ölçülebilir zamana kadar serum ilaç konsantrasyon zaman eğrisi (eğri altındaki alan; AUC0-last) ve ilk uygulamadan sonsuza konsantrasyon zaman eğrisi (AUC0-∞) olarak seçilir. Bununla birlikte, ürünlerin tüm bileşen ve metabolitlerine maruz kalındığından FK ile ilgili tüm testler değerlendirilir (2,4,5).
FK parametrelerin birlikte değerlendirilmesi oldukça önemlidir. Çünkü bazen birincil sonlanım noktası karşılanmadığı halde bilimsel gerekçelerle ve ürüne özgü açıklamalarla diğer parametreler göz önünde bulundurularak ürün yeterlilik alabilir. Bazen de birincil sonlanım noktası karşılandığı halde diğer bulgular biyobenzerliği desteklemeyebilir (33,34).
Filgrastim’e dair iki örnek dikkat çekicidir:
Filgrastim içeren bir biyobenzer ürün ile yapılan çalışmada üretici, intravenöz (iv) ve subkütan (sc) uygulanan ve 4 farklı dozun (1 μg/kg, 2.5 μg/kg, 5 μg/kg ve 10 μg/kg, s.c.; 5 μg/kg, iv) sonuçlarıyla EMA’ya başvuru yapmıştır. Düşük dozlarda ve çoklu s.c. uygulamalarda Cmax ve AUC ölçümleri kabul edilen denklik aralıklarını tutturamamıştır. Bu çalışmada referans ürünle biyobenzer arasındaki saflık derecesinin farklı olduğu ve buna bağlı olarak ölçümlerde sistematik bir hatayla referans ürün için artmış biyoyararlanım durumunun ortaya çıktığı tezi savunulmuştur. Enzyme - linked immunosorbent assay detectable dose yöntemiyle AUC kriterleri yakalanmıştır. Fakat Cmax değerleriyle kabul edilen denklik kriterleri yine de sağlanamamıştır. Üretici buna rağmen ortaya çıkan farkı modelleme sonuçları ve etki mekanizmasına dair yorumlarla FK olarak ortaya çıkan aradaki küçük farkların FD sonuçlara etki etmediğini savunmuştur (33). Bu çalışma bulguları ve süreçle bu biyobenzer ürün EMA onayı almıştır.
Filgrastim içeren iki farklı biyobenzer ürünün iki ayrı çalışmasında ise CHMP’nin talep ettiği %80–125’lik sınırlarında ve %90 güvenlik aralığında denklik kriterleri sağlansa da AUC0– 32 ve AUC0–∞ ölçümlerinin biyobenzer ve referans ürün arasında anlamlı şekilde farklılık göstermesi nedeniyle CHMP bunu yeterli görmemiştir. Üretici başka analizler ve kanıtlar sunmak zorunda kalmıştır. Bu iki örnek biyobenzer çalışmalarının ve onay süreçlerinin keskin kriterlerle değil, aşama aşama bilimsel gerekçelerin ve kanıtların ortaya konmasıyla süregiden dinamik bir süreç olduğunun da göstergesidir (34).
Sonlanım noktaları açısından biyobenzerlerle yapılan FK/FD çalışmaları Faz I çalışmalar olarak isimlendirmek zaman zaman anlaşılma sorunları yaratabilmektedir. Şöyle ki bazı küçük biyolojik ürünlerde FK/FD çalışmalar biyobenzerliğin gösterilmesi için yeterli kabul edilebilmektedir. FK ve FD sonuçlar da Faz III çalışmaların sonlanım noktaları olabilmektedir. Dolayısıyla biyobenzer çalışmaları FK/FD çalışmalar ve Faz III etkinlik çalışmaları olarak tanımlanabilir. Eğer biyobenzerlerle yapılan çalışmada primer sonlanım noktası FK/FD ölçümler ise bu çalışmalar FK/FD çalışma olarak değerlendirilebilir. Eğer çalışmanın primer sonlanım noktası etkililikse ve yanında FK/FD ölçümler de yapılmışsa bu çalışma Faz III etkinlik çalışması olarak değerlendirilebilir. Bu bakış açısıyla biyobenzer ürünün onayının Faz I çalışmayla mı sorusu yerine FK/FD çalışmayla mı alınmış sorusu sorulacaktır (4). Böylece “Faz I mi, Faz III mü yapılmalıdır?” tartışmalarının yerine, çalışma isminden ziyade içeriği hedefleyen bir değerlendirme yapmak mümkün olacaktır. Çünkü biyobenzer Faz I çalışmalar klasik doz bulma çalışmaları değildir. Aynı dozda benzer FK performansı göstermek üzere yapılan çalışmalardır. Bu çalışma tasarımlar çerçevesinde küçük moleküller için modifiye edilerek klinik sonuçların doğru öngörülmesini sağlayacak şekilde FD değerlendirmeler yapılabilir.
Farmakodinamik Değerlendirmeler (35)*
Faz I çalışmalar sırasında kullanılacak FD ölçümleri ilacın klinik sonuçlara etkisini açık, güvenilir ve yüksek duyarlılıkta yansıtmalıdır. Tek bir FD göstergenin kullanılamadığı durumlarda birbirini tamamlayan birden fazla göstergenin kullanılması yoluna gidilebilir (1,2,4,36). FD değerlendirmeler zaman zaman klinik sonuçlar kadar etkin değerlendirme parametreleri olabilmektedir. Örneğin; iki tiroksin preparatının TSH düzeyleri üzerindeki etkilerinin, ötiroidizmin klinik semptomları üzerindeki etkilerine göre daha duyarlı bir karşılaştırmaya olanak sağlayabileceği bilinmektedir.
Etki mekanizması iyi bilinen bir biyolojik ilacın FK değerleri ve FD etkileriyle klinik etkinliği arasında anlamlı bir korelasyon mevcut ise ve Faz I FK/FD karşılaştırma çalışmalarında benzerliğe yönelik ikna edici veriler elde edilirse klinik immünojenisite profillerinin benzer olduğunun gösterilmesi koşuluyla, iki ürün arasında klinik olarak anlamlı farklılıkların olmadığı şeklinde bir çıkarımı desteklemek için yeterli kanıt oluşabilir (1,2,4,36).
Örnek 1. Rekombinant insan insülini ve insülin analogları:
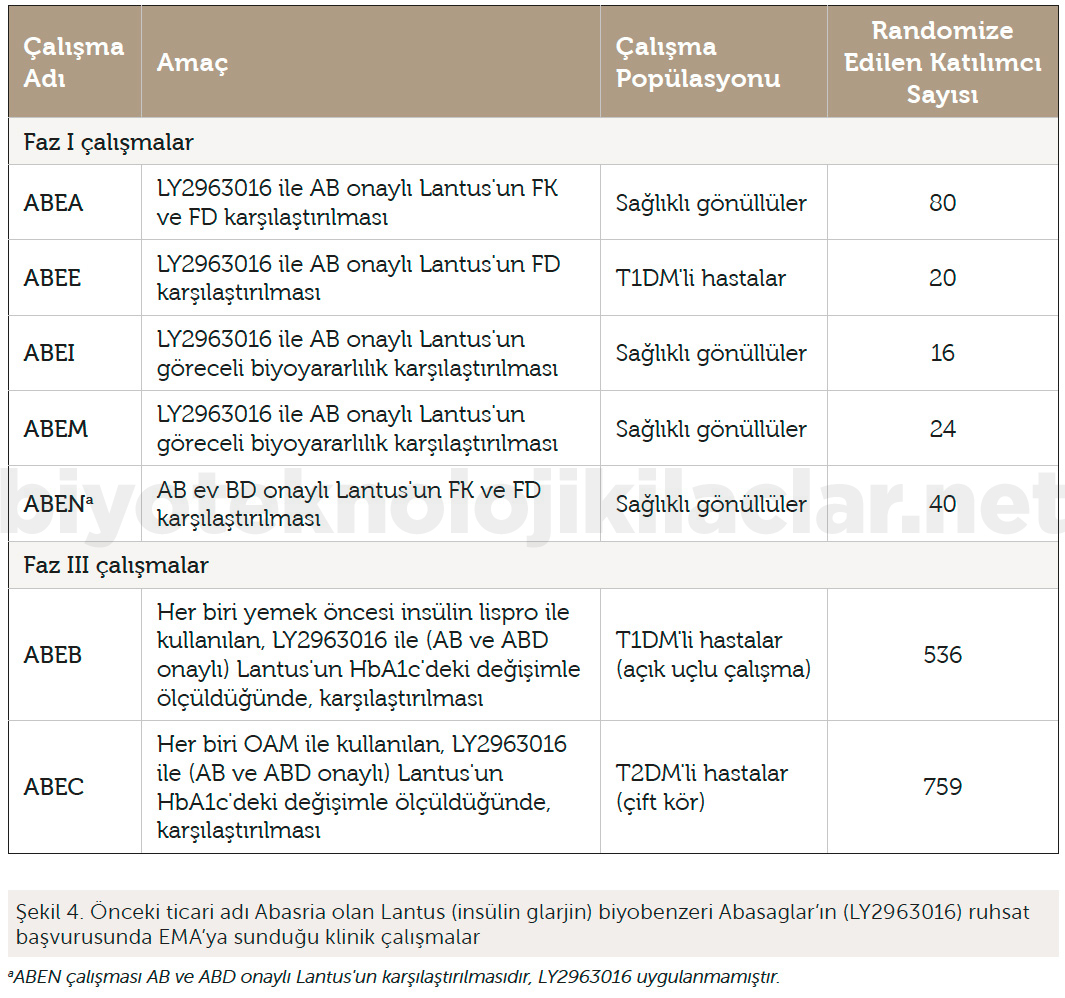
Rekombinant insan insülini ve insülin analoglarının biyobenzerliğini göstermek için öncelikle kalite ve preklinik karşılaştırma çalışmalarıyla referans ilaç ile fizikokimyasal ve fonksiyonel özelliklerin benzerliğinin gösterilmesi gerekmektedir. Bu ön koşul sağlandıktan sonra çapraz tasarımlı, tercihen çift kör, tek doz s.c. uygulamayla gerçekleştirilecek hiperinsülinemik öglisemik Faz I klamp çalışmalarıyla biyobenzer ilaç ile referans ilacın FK ve FD profillerinin benzer olduğunun gösterilmesi, iki ürünün benzer klinik etkililiğe sahip olduğunun temel kanıtını oluşturmaktadır. İnsülin preparatlarının etkililik çalışmalarında sıklıkla kullanılan HbA1c’nin iki insülin preparatı arasındaki klinik olarak anlamlı potansiyel farklılıkları belirlemek için yeterli duyarlılığa sahip olmadığı düşünüldüğünden insülin biyobenzerlerinin referans ürünle benzerliğini göstermek için genellikle Faz III klinik etkililik karşılaştırma çalışmasına gereksinim duyulmamaktadır. Bununla birlikte, klinik güvenlilik çalışmalarının talep edileceği ve bu çalışmalara yeterli sayıda tip 1 diyabetik hastanın dahil edilmesinin bekleneceği unutulmamalıdır. İnsülinlere karşı antikor gelişimi erken bir süreçte beklendiği için genellikle 6 ay süreli bir Faz III çalışmayla biyobenzer insülin ve referans ürüne karşı gelişen antikorların insidansı ve titrelerinin karşılaştırılması yeterli olmaktadır. Biyobenzer insülinin referans insüline benzerliği son derece duyarlı, ortogonal, güncel ve geçerli yöntemlerle yapılan kalite çalışmaları ve FK/FD Faz I karşılaştırma çalışmalarıyla ikna edici bir şekilde gösterilmişse ve iki ürünün safsızlık profilleri ve içerdiği yardımcı maddeler belirli bir endişe uyandırmıyorsa, ruhsatlandırma için yukarda sözü edilen güvenlilik çalışmasına da gereksinim duyulmayabilir (37). Nitekim, insülin glarjin biyobenzeri ürün (LY2963016) referans ürüne biyobenzerliğini kanıtlamak için EMA’ya temel olarak 4 karşılaştırmalı Faz I çalışma sunmuş (ABEN adlı çalışma Avrupa Birliği onaylı referans ürünün Amerika Birleşik Devletleri onaylı referans ürün ile karşılaştırma çalışmasıdır) ve aslında preklinik çalışmalar ve bu 4 Faz I çalışma bazında EMA tarafından biyobenzerliğini kanıtladığı sonucuna ulaşılmıştır. Şekilde yer alan ABEB ve ABEC isimli Faz III klinik etkililik / güvenlilik karşılaştırmalı noninferiorite çalışmaları biyobenzer ürünün FK / FD özelliklerinin tip 1 ve tip 2 diyabetli hastalarda klinik parametrelere nasıl yansıdığını göstererek biyobenzerliğe ilişkin ilave destek sağlamakla birlikte, temel olarak biyobenzer ürünün referans ürünle değiştirilebilirliğine (switch) yönelik gerekli kanıtı sağlamak için kullanılmıştır (Şekil 4) (38).
Örnek 2. Düşük moleküler ağırlıklı heparin içeren biyolojik ilaçlar:
Düşük moleküler ağırlıklı heparin içeren biyolojik ilaçların referans ürüne biyobenzerliğini göstermek için kalite karşılaştırmalarında tatminkâr düzeyde benzerliğe ilave olarak in vitro biyokimyasal aktivite (koagülasyon faktörleri Xa ve IIa inhibisyonu ve aPTT ve Heptest® gibi pıhtılaşma testleri) ve in vivo FD sonlanımların (anti-Fxa, anti-FIIa ve TFPI: Doku faktör yolağı inhibitörü) benzerliğinin sağlıklı gönüllülerde yapılacak tek doz, randomize, iki sıralı, iki periyotlu, çapraz tasarımlı karşılaştırmalı bir biyoyararlanım ve FD biyoeşdeğerlik (Faz I) çalışmasıyla gösterilmesi genellikle yeterlidir. Özellikle trombosit faktör 4 (PF4)-enoksaparin kompleks oluşumundan kaynaklanabilecek immünojenisite açısından fark olmadığının uygun yöntemlerle karşılaştırmalı testlerle ikna edici bir şekilde gösterilmesi durumunda, biyobenzerlik için klinik Faz III çalışmasına gereksinim duyulmayacak, aksi taktirde karşılaştırmalı bir Faz III klinik güvenlilik / immünojenisite çalışmasıyla Heparin Platelet Faktör 4 (HPF4)-antikorlarının belirlenmesi ve heparinle indüklenen trombositopeni tip II (HIT II) olaylarının belirlenebilmesi için trombosit sayılarının zorunlu monitorizasyonu talep edilecektir (39). Nitekim düşük moleküler ağırlıklı iki heparin biyobenzerin EMA tarafından ruhsatlandırılması sırasında klinik etkililik çalışmalarına gereksinim duyulmamıştır. Diğer taraftan başvuru sahiplerinin biyobenzer ürünlerinin referans ürüne güvenlilik (immünojenisite) açısından benzerliğini göstermeye yönelik sundukları klinik ve preklinik veriler yeterli görülmemiş, geçerli yöntemlerle yapılan kapsamlı ilave in vitro çalışmalarla referans ürünle biyobenzer ürün arasında immünojenisite açısından fark olmadığının gösterilmesi sonrasında biyobenzerliğe onay verilmiştir (39).
Örnek 3. Rekombinant insan granülosit-koloni stimüle edici faktör (rhG-CSF):
Filgrastim EMA, granülosit-koloni stimüle edici faktör (G-CSF) için mutlak nötrofil sayısını, vekil bir FD gösterge / biyogösterge olarak kabul etmektedir. Dolayısıyla mutlak nötrofil sayısı üzerinde biyobenzer ve referans ilaçların benzer bir etki göstermesi, klinik sonlanım üzerinde de benzer etki göstereceklerine işaret etmektedir (40). Filgrastim biyobenzerinin referans ürün ile benzerliğini ispatlamak üzere EMA’ya yapılan başvurusunda preklinik karşılaştırma verileri ile birlikte hem düşük hem yüksek dozları içeren 4 ayrı Faz I FK/FD karşılaştırma çalışması sunulmuştur (Şekil 5). FD karşılaştırma çalışmalarında primer FD parametre olarak rekombinant insan granülosit-koloni stimüle edici faktör için önerilen vekil (surrogate) gösterge olan mutlak nötrofil sayısı, sekonder FD parametre olarak CD34 hücre sayısı alınmıştır. Ayrıca tüm Faz I çalışmalarda güvenlilik karşılaştırması gerçekleştirilmiştir. Bu çalışmalarla biyobenzer ürünün klinik etkililiğinin ve güvenliliğinin referans ürünle benzer olduğuna dair güçlü kanıtlar oluşması sonucunda EMA tarafından firmadan sadece bir Faz III primer güvenlilik çalışmasıyla (Tek kollu-referans ile karşılaştırma yok) gerekli güvenlilik verisini tamamlaması talep edilmiştir (40). Aynı ürünün FDA tarafından biyobenzer olarak onaylanma sürecindeyse mevcut 4 FK/FD çalışmaya ek olarak Amerika Birleşik Devletleri’nde ruhsatlı referans ürün ile Faz I (FK/FD) karşılaştırma çalışması ve biri ruhsatlandırma öncesinde (primer etkililik, sekonder güvenlilik, referans ürün ile karşılaştırmalı), diğeri ruhsatlandırma sonrasında (primer güvenlilik, sekonder etkililik, tek kollu) olmak üzere iki Faz III çalışma gerçekleştirilmiştir (Şekil 6) (41).
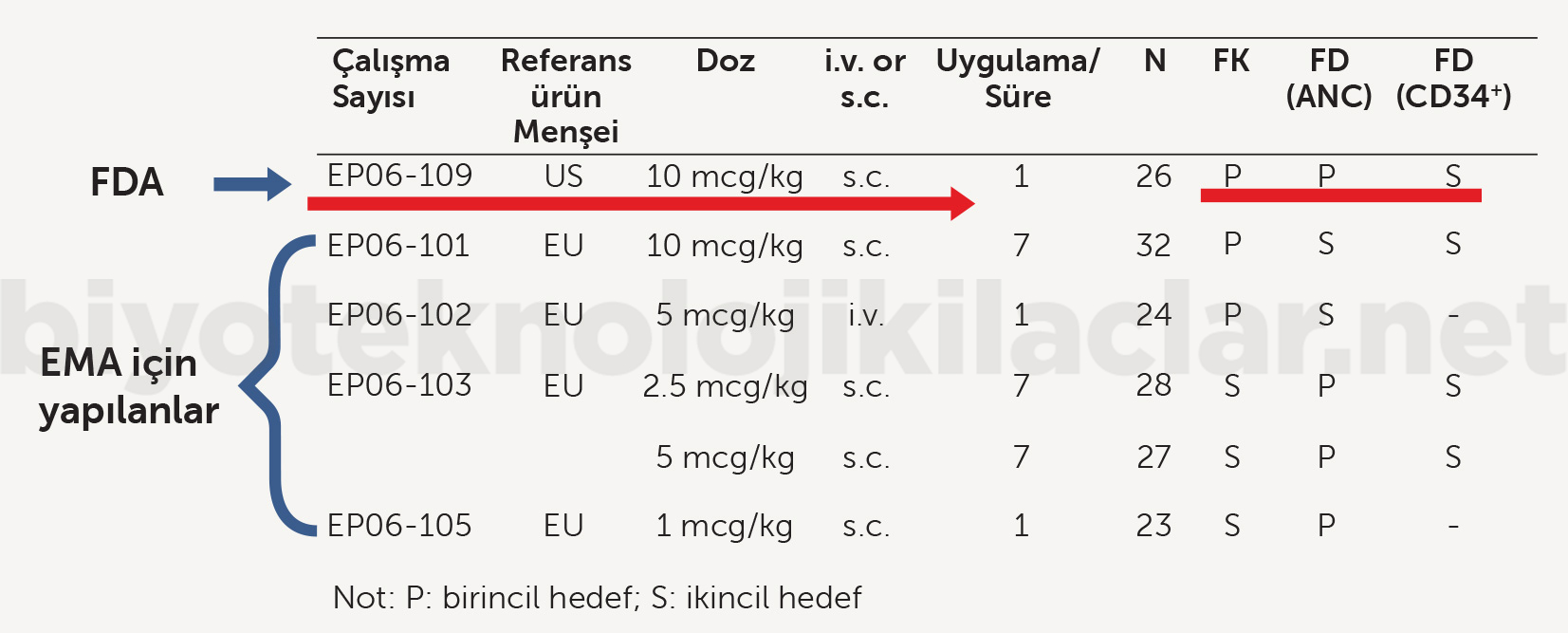
Şekil 5. Filgrastim biyobenzerin referans ürüne benzerliğini ispatlamak için gerçekleştirdiği Faz I çalışmalar
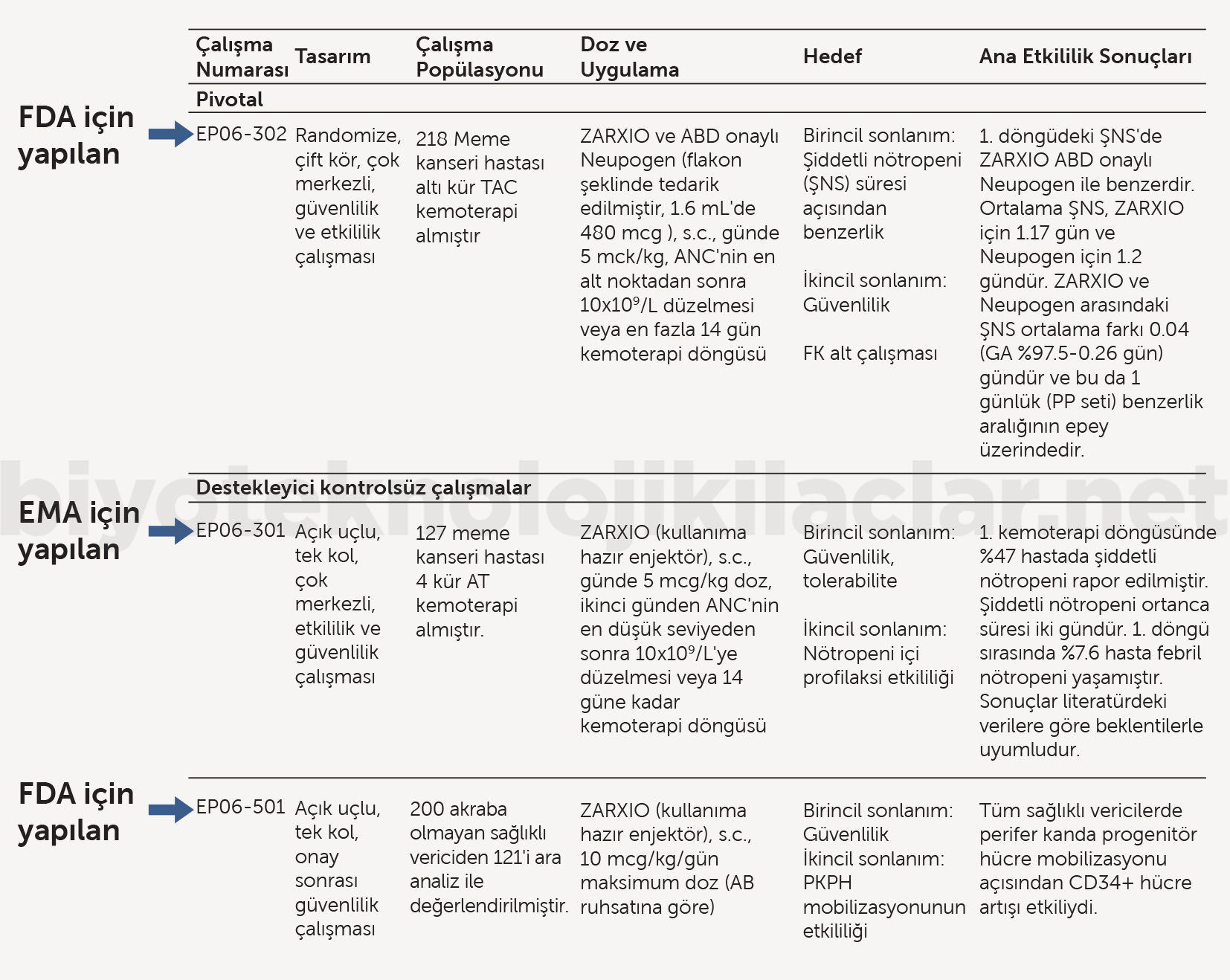
Şekil 6. Biyobenzer filgrastim’in referans ürün ile benzerliğini ispatlamak için gerçekleştirdiği Faz III çalışmalar
Yukarıdaki örneklerden anlaşılacağı ve EMA’nın da vurguladığı üzere FK/FD çalışmalarla biyobenzerlik değerlendirmesi, etki mekanizması iyi tanımlanmış, klinik sonuçları yüksek duyarlılıkta gösterebilecek G-CSF, eritropeotin ve insülin gibi küçük molekül yapısına sahip biyolojik ürünler için geçerlidir. Daha büyük moleküller için kalite ve karşılaştırılabilir preklinik veriler sağlansa bile klasik klinik etkililik sonlanım noktasını kullanan çalışmalar gereklidir. Küçük moleküllerin her biri ürün bazlı değerlendirilerek Faz I çalışmanın yanı sıra Faz III çalışma yapılma gerekliliğine bakılmalıdır.
FAZ II ÇALIŞMALAR
Faz II çalışmalar yeni geliştirilen bir ürünün hedef hasta grubunda ön etkililik değerlendirme çalışmalarıdır. Biyobenzerler zaten etkin bir referans ürünün yüksek benzeri moleküllerdir. Belli ölçüde etkin olmaları beklenmektedir. Araştırma konusu hedef hasta kitlesinde etkililik değerlendirmesi değil, biyobenzerlerin referans ürün kadar etkin olup olmadığının araştırılmasıdır. Biyobenzer çalışmalarının amacı yüksek benzer olduğu referans ürünle rezidüel belirsizliklerin varsa klinik sonuçlarını ortaya koymaktır. Dolayısıyla biyobenzerler için ön etkililik değerlendirme Faz II çalışmalarına gerek yoktur. Biyobenzer ürünler Faz I ve Faz III çalışmalarla değerlendirilir (1-5).
FAZ III RANDOMİZE KONTROLLÜ ÇALIŞMALAR
Randomize kontrollü çalışmalar yeni ilaçların etkililik ve güvenliliğinin değerlendirilmesi için altın standart yöntemlerdir. Bu çalışmaların asıl gücü deneysel kolla karşılaştırılan grup arasında bilinen ve bilinmeyen değişkenlerin olabildiğince dengelenmesinden kaynaklanır. Randomizasyonun yapılmadığı ya da yapılamadığı diğer çalışma yöntemlerinde ise sonuçların karşılaştırmalı yorumunu kısıtlayan, değerlendirmede sorunlara neden olan bilinen ve bilinmeyen değişkenler arasında dengesizlikler mevcuttur. Randomize kontrollü çalışmalar, birincil sonlanım noktası (primary endpoint) olarak tanımlanan bir klinik soru veya hipotezi test etmek için tasarlanmaktadır. Birincil sonlanım noktasını önceden belirlenmiş bir doğruluk derecesiyle değerlendirmek için randomize kontrollü çalışmalarda örneklem büyüklüğünün hesaplanması bu çalışma metodolojisinin en kritik aşamalarındandır. Örneklem büyüklüğü belirlenirken deneysel kolla kontrol kolu arasındaki farkın klinik olarak anlamlı olacak büyüklüğüyle kabul edilebilir yanlış negatiflik (alfa) ve gerçek pozitiflik (güç [power] ya da 1-beta) oranlarının tanımlanması kritik önemli aşamalardır. Bütün randomize kontrollü çalışmaların bir geçersizlik hipotezi (null hypotesis) ve bir alternatif hipotezi (alternative hypothesis) olmalıdır. Randomize kontrollü çalışmalar geçersizlik hipotezini reddetmeyi amaçlar (Şekil 7) (2,42-45).
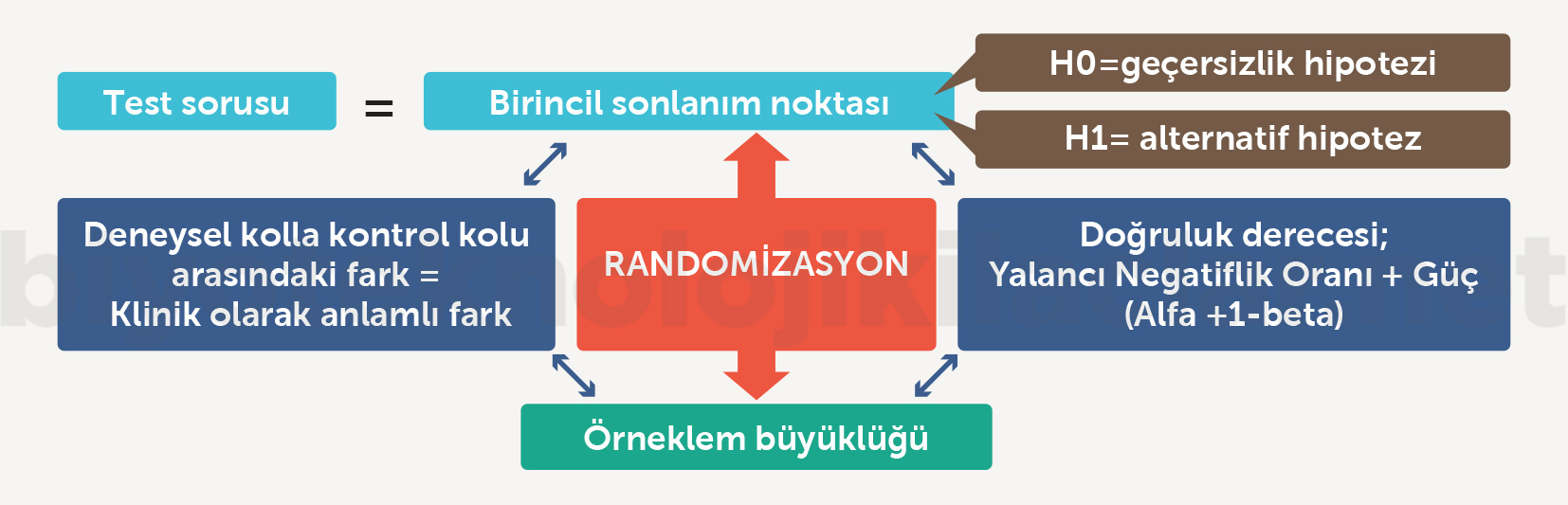
Şekil 7. Randomize kontrollü bir çalışmada etkililik ve güvenlilik değerlendirmesi için kritik basamaklar
Randomize kontrollü çalışmalar, birincil sonlanım noktası yanı sıra çalışma kolları arasında ek bulguları değerlendirmek için ikincil sonlanım noktaları ve alt grup analizleri içerir. Randomize kontrollü çalışmalarda ikincil sonlanım noktaları ve alt grup analizleri, çalışma bütünü içerisinde sonuçların tutarlılığı ve tedavi sürecine dair ek bilgiler sağlamakla beraber çalışmaların test sorusunu oluşturmaz. Örneklem kitlesi, randomizasyon, yanlış negatiflik oranı ve çalışma gücü birincil sonlanım noktasına göre tanımlandığı için çalışma sonuçları, ikincil sonlanım noktaları ve alt grup analizleri birincil sonlanım noktasına benzer şekilde yüksek kanıt düzeyine sahip olamaz. Çalışma tasarımının test gücü ikincil sonlanım noktaları ve alt grup analizler için zayıflamaktadır (46).
Randomize kontrollü çalışmalar etkililik ve güvenlilik değerlendirme sürecinde araştırma ürününün kullanım amacına göre 3 başlıkta tanımlanır.
✓ Üstünlük çalışmaları (Superiority trials)
✓ Yeterlilik çalışmaları (Non-inferiority trials)
✓ Denklik çalışmaları (Equivalence trials)
Bu çalışmaların yukarıda bahsedildiği üzere bir geçersizlik hipotezi bir de alternatif hipotezleri vardır. Çalışmaların sonucu bu iki hipotezden birinin kanıtını sağlar. Üçüncü bir hipoteze kanıt olarak değerlendirilemez. Örneğin üstünlük çalışmasının sonucunda kollar arasında fark olmaması kolların benzer sonuç gösterdiği şeklinde yorumlanamaz. Ya araştırılan kol üstündür (alternatif hipotez) ya da üstün değildir (geçersizlik hipotezi). Bu nedenle biyobenzer ilaçlara dair çalışmalar yeterlilik ve denklik çalışmalarıdır. Hem çalışma tasarımı açısından hem de üretilme gerekçeleri açısından üstünlük çalışmaları biyobenzer ilaçlar için yapılamaz (2,42-45,47,48).
Referans ilaç ve biyobenzer ilacın varlığında yeni bir biyobenzer geliştirilirken yeni biyobenzerle yapılan çalışmalarda karşılaştırma kolunda referans ürün kullanılmak zorundadır. Çünkü denklik ve yeterlilik çalışmalarında evrensel değer kabul edilen referans ürünün etkililiğinden bir miktar sapmalar söz konusudur. Biyobenzer ürünlerin etkililikleri tespit edilirken referans ürün yerine başka bir biyobenzer ile karşılaştırılırsa, karşılaştırılan biyobenzerin de referans ilaca göre sapması da olacağından etkililik oranı doğru saptanamaz.
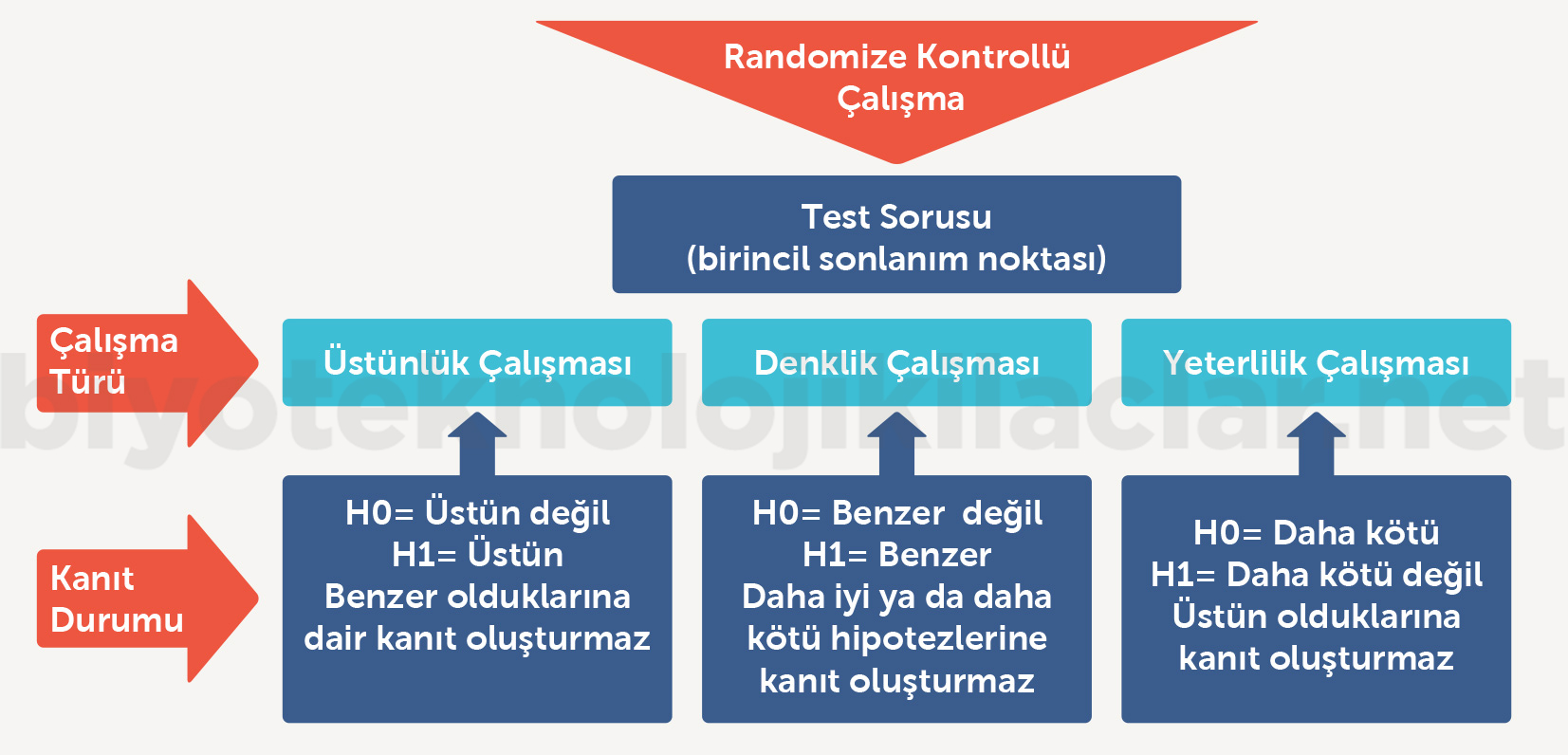
Şekil 8. Çalışma tasarımına göre test soruları ve sonlanım noktalarının yorumu
Üstünlük Çalışmaları (Superiority Trials)
Araştırma ürününün karşılaştırma kolundan daha üstün olduğunu göstermek için tasarlanan çalışmalardır. Bu çalışmaların geçersizlik hipotezi araştırma ürününün kontrol kolundan daha iyi olmadığıdır. Dolayısıyla bu çalışmalar araştırma ürününün daha iyi olduğunun kanıtını oluşturmaya çalışır. Üstünlük çalışmaları alfa ve istatistiksel güç kavramlarının en ilişkili olduğu çalışmalardır. Örneklem büyüklüğü deneysel kolla kontrol kolu arasındaki farkın büyüklüğünü saptayabilecek yeterlilikte olmalıdır (42-48).
Üstünlük çalışmalarının geçersizlik hipotezi araştırma kolunun kontrol kolundan üstün olmadığıdır. Dolayısıyla çalışmada p değeri anlamlı anlamlı bulunursa alternatif hipotez kanıtlanır ve üstünlük durumu deklare edilir. Eğer p değeri anlamlı saptanamazsa o zaman geçersizlik hipotezi kanıtlanmış olur ve araştırma kolunun üstün olmadığı deklare edilir. Bu çalışmalarda kolların benzer olduğu sonucuna varılamaz ve deklare edilemez. Çünkü üstünlük sınırı belirlenmiş ve o sınırın üzerinde bir sonuç sağlanması hedeflenmiştir. Bu hedef sağlanamadığı takdirde üstünlük sınırından farklı olan ve benzerlik için gereken sınırların karşılanıp karşılanmayacağı bu çalışma tasarımı içinde belirsiz kalır ve kanıt oluşturulamaz. Denklik ya da benzerlik deklare edilemez. Dolayısıyla biyobenzer ilaçlar tüm geliştirme sürecinde referans ilaca benzer olmak amacıyla geliştirildiğinden üstünlük çalışması biyobenzer ilaçlar için uygun olamaz. Üstünlük çalışması ancak “biyoüstün” olma durumunda söz konusu olabilir (42-45,47).
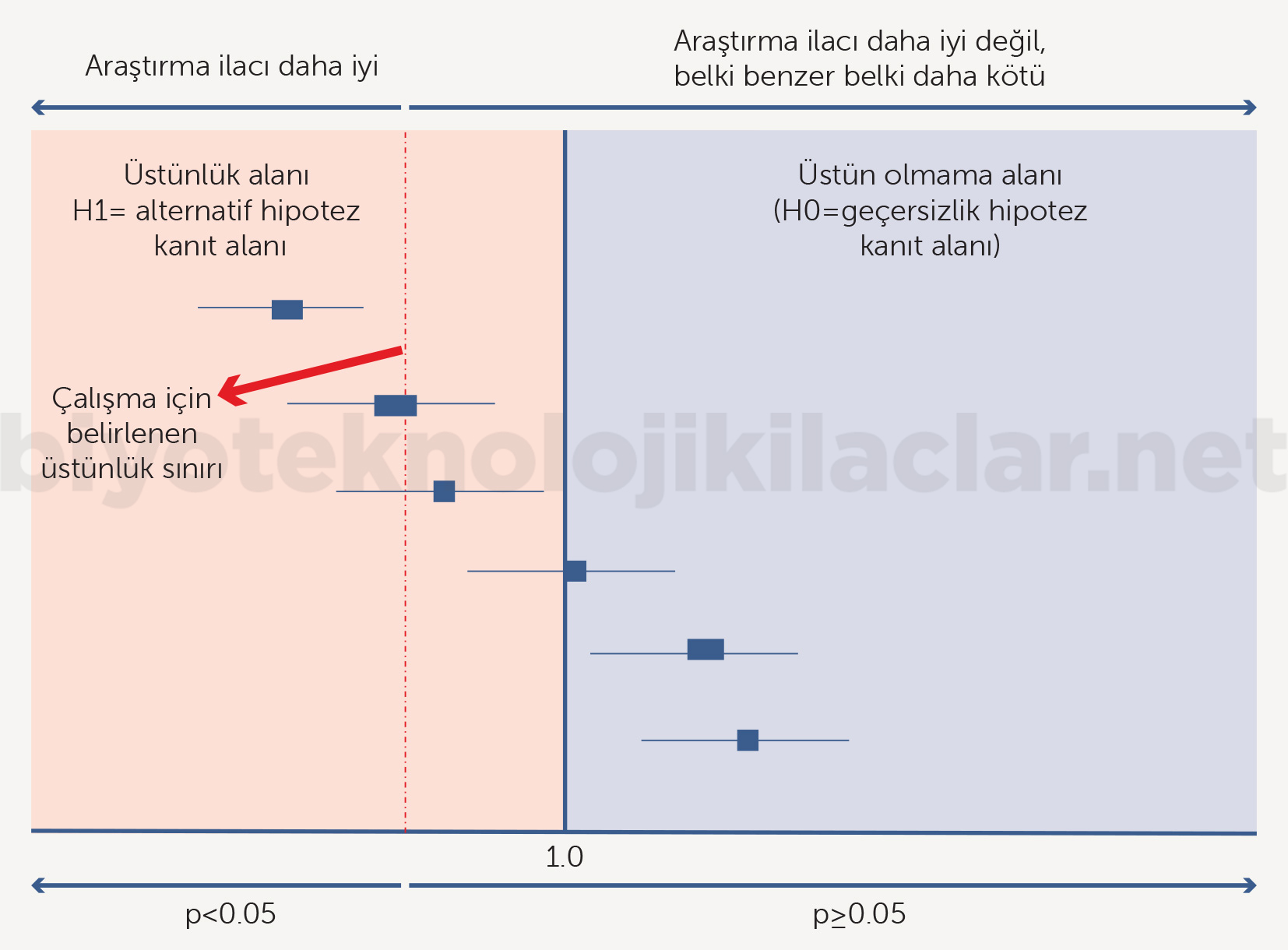
Şekil 9. Üstünlük çalışmaları sadece araştırma ürününün üstün olup olmadığını test eder. Denklik ya da yeterlilik sorularına yanıt vermez. Yeni bir üründe zaman zaman üstünlük çalışmalarından yeterlilik sonuçları için çıkarım yapılabilir ve endikasyon oluşturulabilir. Ancak bu durum denklik için söz konusu değildir. Aynı zamanda bu tartışmalar biyobenzer çalışmalarının konusu değildir.
Denklik Çalışmaları (Equivalence Trials)
Araştırma ürününün standart tedaviye etkililik açısından benzer olduğu kanıtlanmaya çalışıldığı zaman standart tedaviye göre uygulama kolaylığı, güvenlilik ve ucuzluk gibi ek avantajları olmalıdır. Denklik çalışma tasarımının geçersizlik hipotezi araştırma ürünüyle standart tedaviye benzer değildir (daha iyi ya da daha kötü olabilir şeklindedir). Alternatif hipotez ise ‘iki tedavi benzerdir’ şeklindedir. Böylece çalışmanın amacı geçersizlik hipotezi olan ‘iki ilaç benzer değildir’ hipotezini reddetmek ve alternatif hipotez olan ‘iki ilaç benzerdir’ hipotezini kanıtlamaktır. Denklik çalışmalarında sadece benzerlik test edilir, üstünlük ya da daha kötü olma durumu test edilemez (2,42-48).
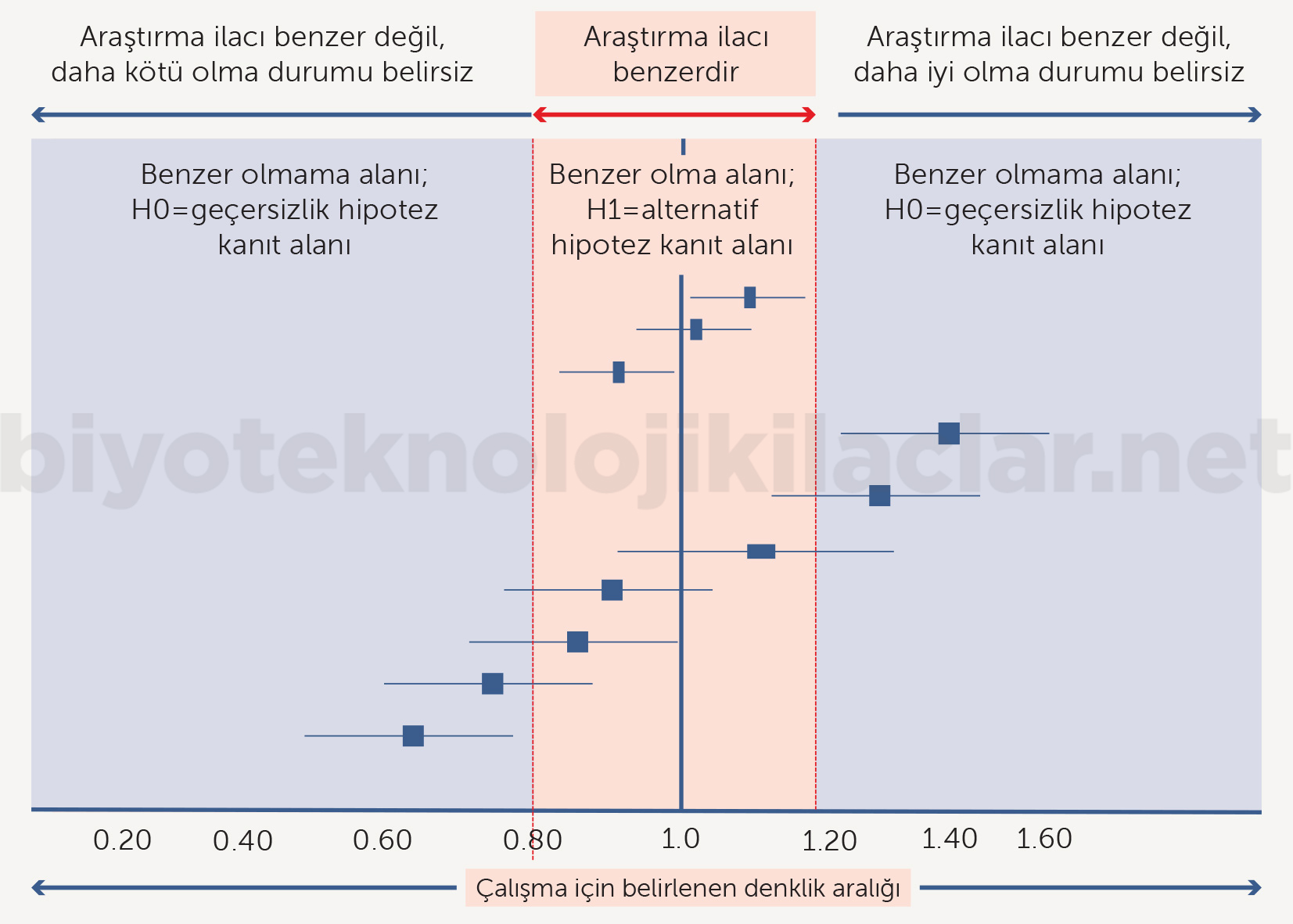
Şekil 10. Denklik çalışmaları araştırma ilacının referans ilaçta belirlenen sınırlarda denk olup olmadığını test eder, üstünlük ya da daha kötü olma durumunu ortaya koymaz. Çalışma denkliği göstermek için yapılmıştır.
Denklik çalışmalarında en önemli noktalardan biri üstünlük çalışmalarındaki üstünlük için anlamlı fark sınırının yerine daha dar bir aralıkta olan denklik sınırının (delta, Δ) kullanılmasıdır. Üstünlük sınırıyla denklik sınırının üst sınırı aynı değerler değildir ve denklik çalışmalarında belirlenen denklik sınırı genel olarak üstünlük sınırının altındadır (Şekil 11). Denklik sınırı, minimal klinik anlamlı fark olarak tanımlanan araştırma ilacının getireceği diğer avantajlar yanında görmezden gelinebilecek bir farktır. Dolayısıyla denklik çalışmalarında denklik sınırının saptanması kritik öneme sahiptir (2,42-48).
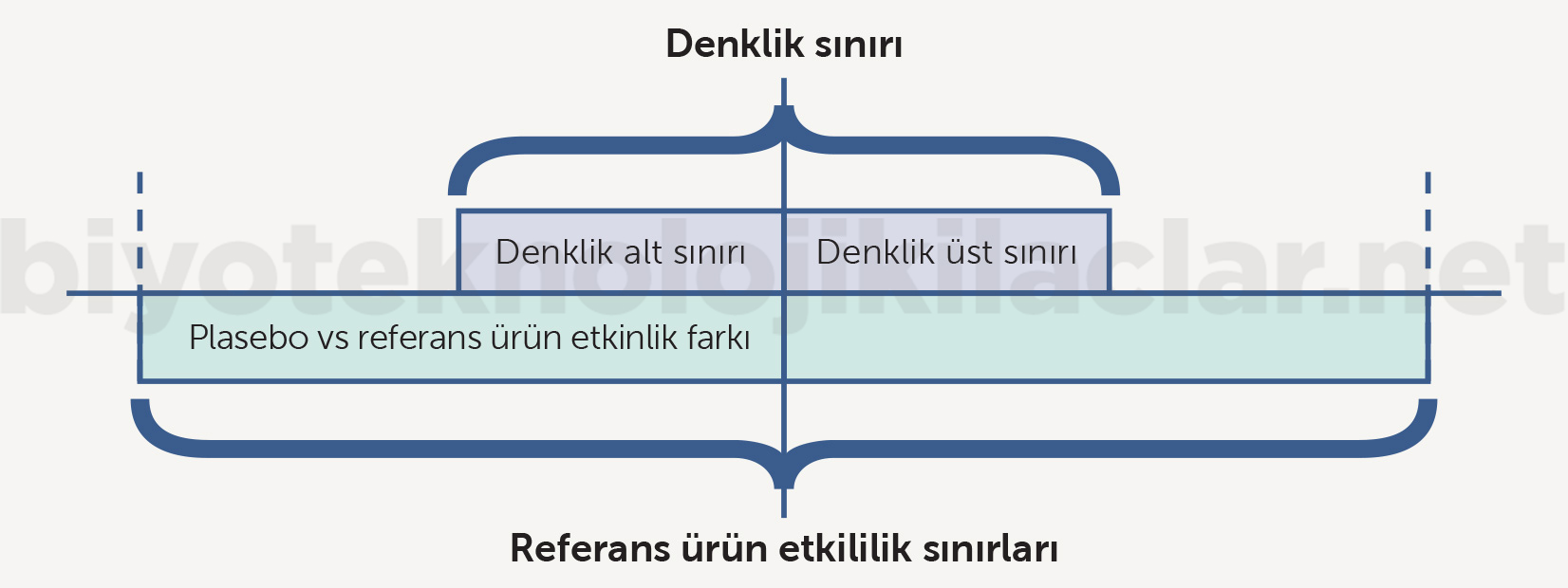
Şekil 11. Yeni geliştirilen bir ilacın üstünlük sınırıyla var olan ilaca denk olarak geliştirilen bir yeni ilacın denklik sınırları aynı değildir. Bu nedenle denklik sınırları üstünlük tartışması için kriter olamaz.
Denklik sınırlarının hesaplanması için değişik yöntemler vardır; EMA yeterlilik çalışmalarında %95 güven aralığı önermektedir. Güven aralığından sonra iki tedavi arasındaki minimal klinik öneme sahip ve denklik çalışması için kabul edilebilir farkı saptamak diğer kritik noktadır. Burada önce eski çalışmalara göre ve mümkünse meta analizlerle ortaya konmuş standart tedavi etkililik derecesi saptanır. Saptanan etkililik derecesi %95 güven aralığında standart tedaviyle plasebo arasındaki farkı oluşturan alandır (kontrol tedaviyle plasebo arasındaki mutlak etki farkı) (Şekil 12) (42-48).
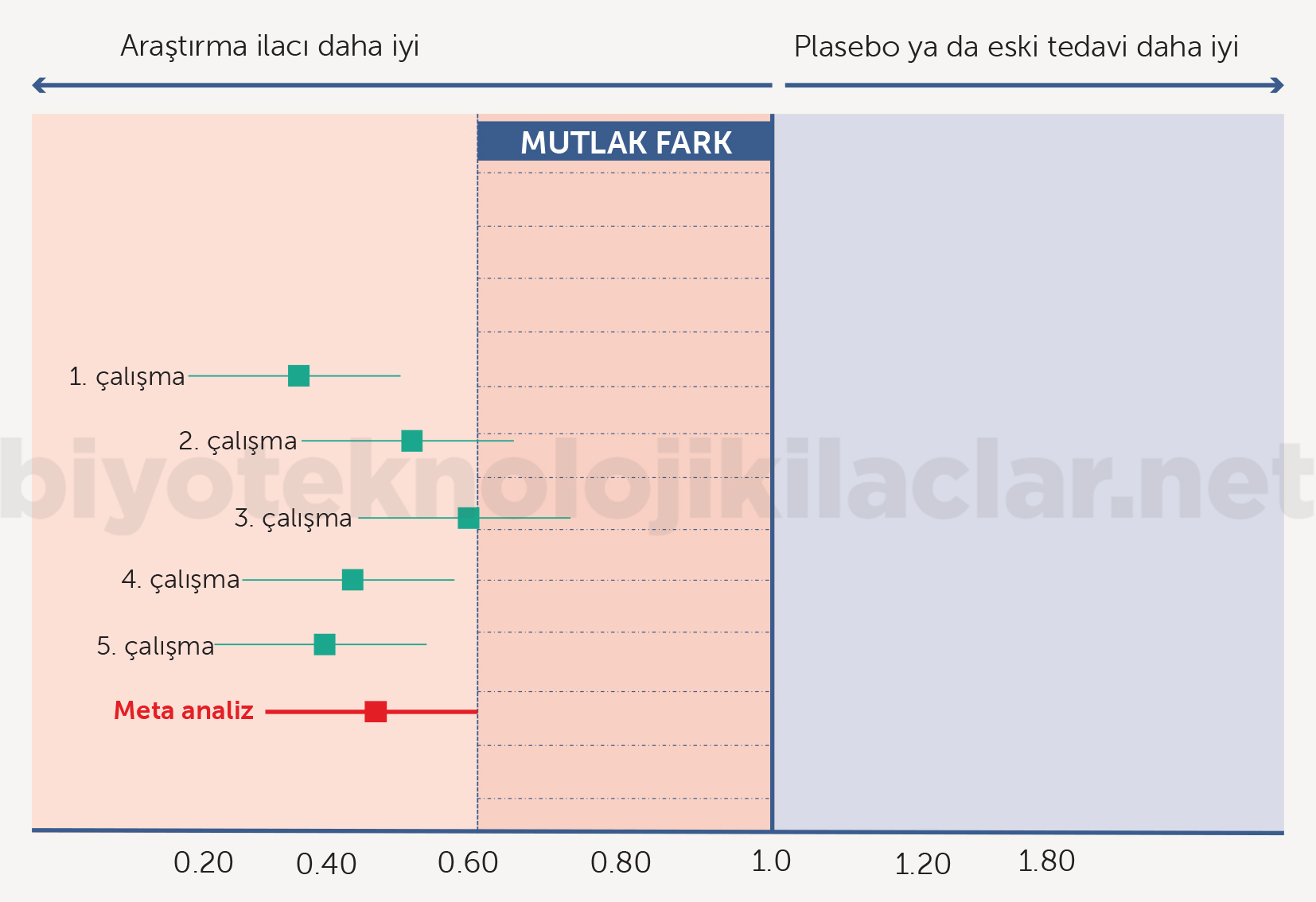
Mutlak etki farkı hesaplandıktan sonra genellikle ilgili otoriteyle görüşülerek mutlak etki farkının içinden bir denklik ya da yeterlilik sınırı belirlenir. Bu da genellikle mutlak etkinin %50-70 arasında bir sınıra denk gelecek şekilde oluşturulur (Şekil 13). Bununla birlikte denklik sınırı, her bir ilacın mutlak etki farkı düzeyi ve denklik çalışmasında kullanılan ilaçtan beklentilere göre otoriteyle tartışılarak oluşturulur. Biyobenzer ilaçlar için belirlenen denklik ya da alt sınır aralığı (Δ) klasik olarak denklik ve yeterlilik çalışmalarında uygulanan bu yöntemlerle belirlenir (Şekil 14). Denklik çalışmalarında yeterlilik çalışmalarından farklı olarak benzerliğin alt sınırı aynı zamanda üst sınır olarak da kullanılır (simetrik sınırlar). Doz ilişkili toksisiteler söz konusuysa veya kullanılan doz, doz-yanıt eğrisinde plato çizmeye yakın bir değer ve doz ilişkili yanıt farkı olasılığı küçükse üst sınır alt sınırdan farklı (asimetrik sınırlar) olabilir (42-48).
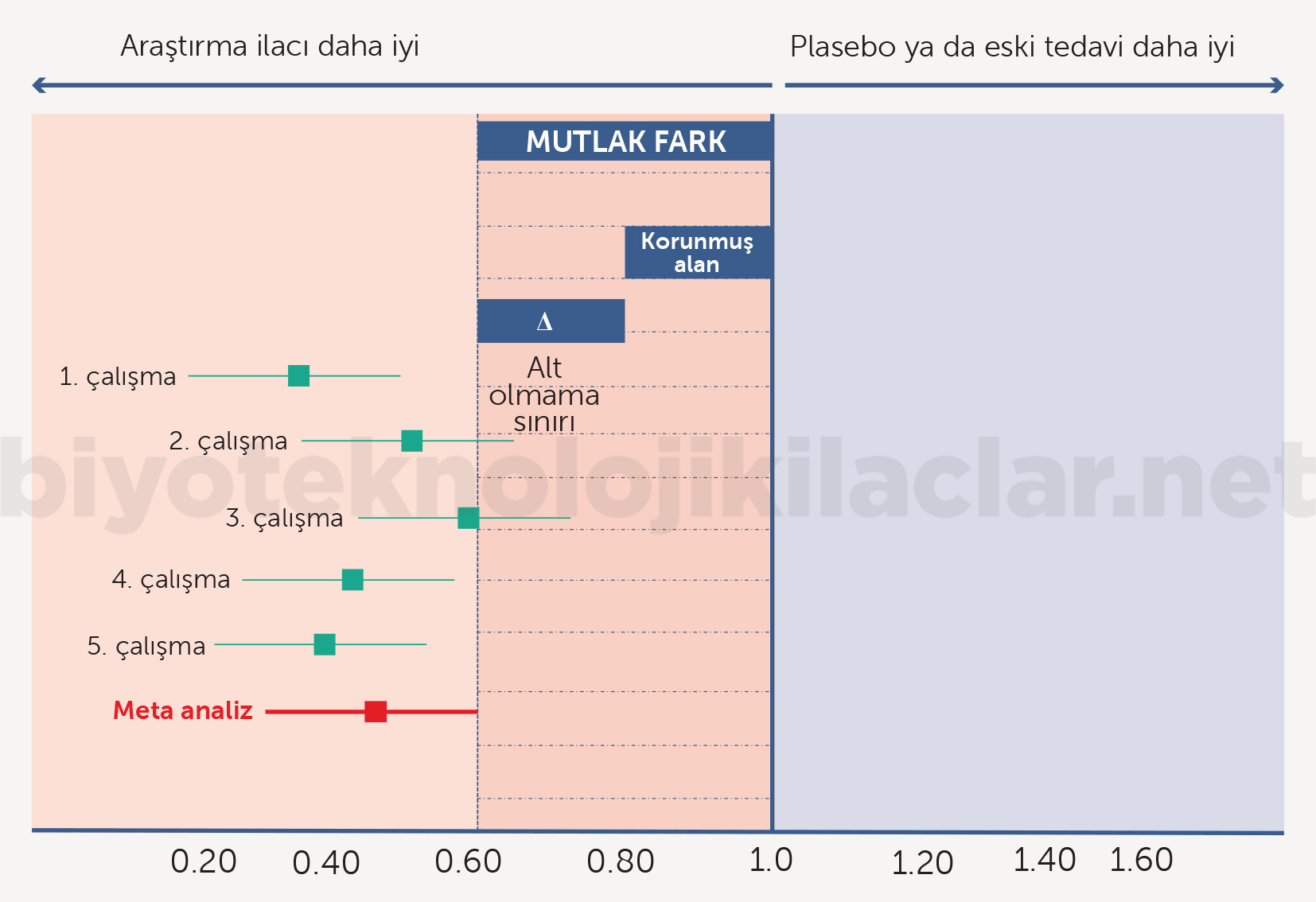
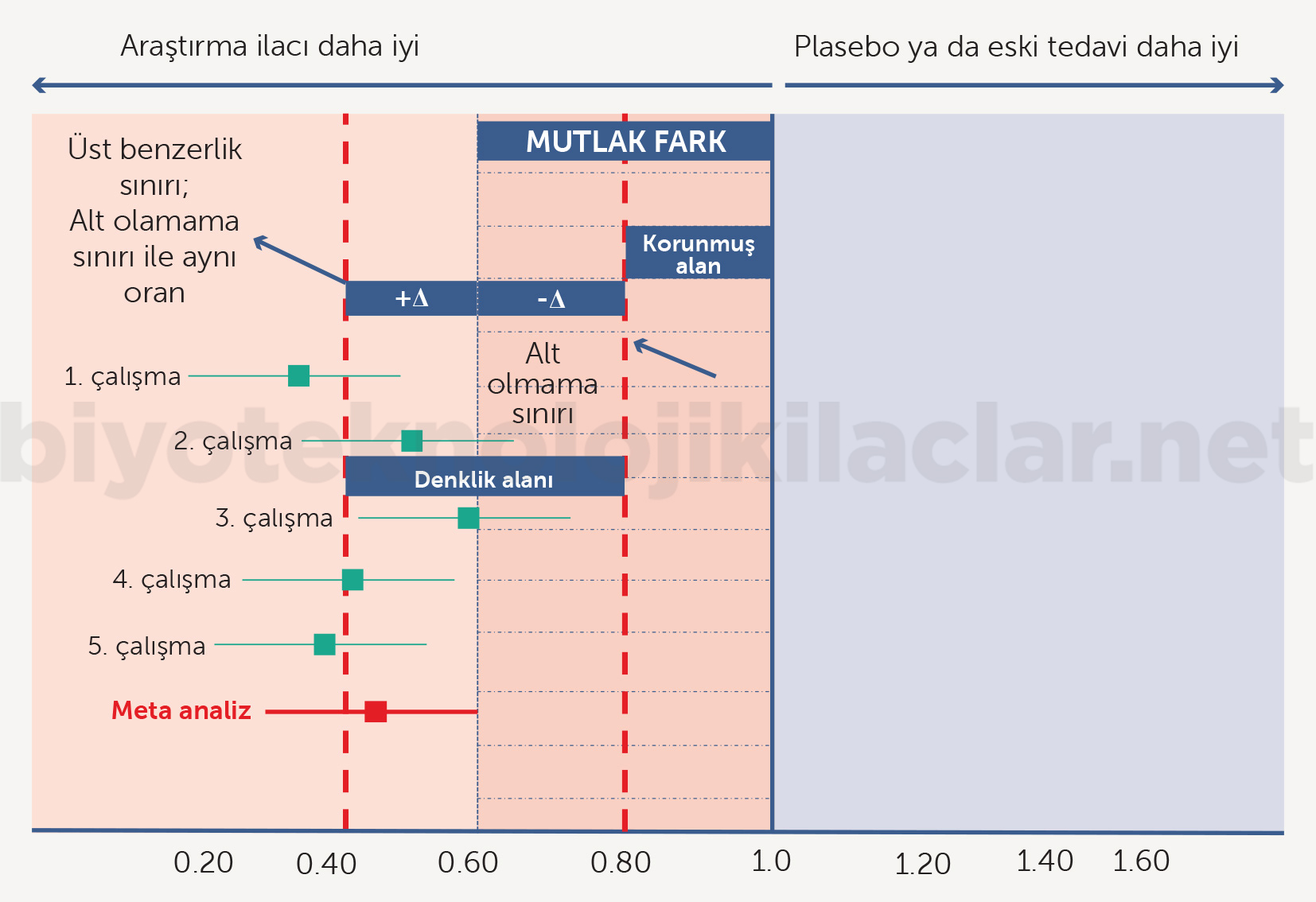
Hesaplanan alt sınır aralığının büyüklüğü, yanlış negatiflik oranı ve güç hesaplarıyla
örneklem büyüklüğü hesaplanır. Önceden belirlenmiş denklik sınırı (Δ) biyobenzer çalışmalarında son derece önemlidir.
Yeterlilik Çalışmaları (Non-Inferiority Trials)
Üstünlük çalışmaları deneysel kolun kontrol kolundan üstün olup olmadığını test ederken, denklik çalışmaları deneysel kolun kontrol koluna benzer olup olmadığını araştırır. Yeterlilik çalışmaları ise hibrit çalışmalardır. Deneysel kolun denklik çalışmalarında olduğu gibi önceden belirlenmiş bir sınırla en az kontrol kolu kadar etkin olduğunu göstermeye çalışır. Diğer yandan üstün olma kanıtını deklare etmek için yetersizken, üstün olma durumu için hipotez oluşturur. Bu çalışmalarda test edilen bir üstünlük sınırı belirlenmemiştir. Örneklem büyüklüğünün temel belirleyen bileşeni yeterlilik alt sınırıdır. Yeterlilik çalışmaları özellikle yeni ilaçların geliştirilme sürecinde üreticilere avantajlar sağlar. Etkililik dışında avantajları olan yeni bir ilaç üstün olmasa bile yeterlilik durumu nedeniyle uygulamaya girebilir.
Biyobenzer ürünün referans ürüne göre daha etkin olmayacağı bilimsel ve mekanistik olarak öngörülebiliyorsa yukarıdaki endişeler ortaya çıkmayacağından bir biyobenzer ürün için denklik çalışmaları yerine yeterlilik çalışmaları yapılabilir. İnfliksimab ve biyobenzeri CTP-13 Crohn Hastalığında randomize, çift kör, noninferior bir çalışma tasarımıyla karşılaştırılmıştır (49). Benzer şekilde Rituksimab biyobenzeri RTXM83 diffüz büyük B hücreli lenfomalı hastalarda ve CP-P10 foliküler lenfomalı hastalarda yanıt oranları birincil sonlanım noktası belirlenerek randomize çift kör noninferior çalışma tasarımlarıyla karşılaştırılmıştır (50,51).
Yeterlilik çalışmalarında kontrol grubuna göre yeterlilik ya da benzer olma alt sınırı denklik çalışmalarındaki benzerlik sınırının belirlendiği gibi belirlenir. Tamamen aynı kurallar uygulanır. Bununla beraber denklik çalışmalarındaki üst sınır kavramı yeterlilik çalışmalarında yoktur ve bu nedenle yeterlilik çalışmalarının yorumu daha karışıktır. Yeterlilik çalışmalarında 6 sonuç ortaya çıkabilir (42);
1. Deneysel kol daha kötüdür.
2. Yeterlilik karşılanmamıştır ama alt sınır aralığı açısından tartışmaya açıktır.
3. Deneysel kol denklik sınırı içindedir ama daha kötüdür; tartışmaya açık bir bulgudur.
4. Deneysel kol alt değildir.
5. Deneysel kol istatistiksel olarak üstündür ama klinik olarak değildir.
6. Deneysel kol üstündür.
Biyobenzer çalışmaları zaman zaman yeterlilik çalışması şeklinde tasarlanabilmektedir. Bununla birlikte randomize kontrollü çalışmalar içinde biyobenzerlik kavramına en uygun çalışmalar denklik çalışmalarıdır. Yeterlilik çalışmalarında sadece birincil sonlanım noktası değil, ikincil sonlanım noktası ve alt grup analizlerinde ortaya çıkabilecek istatistiksel üstünlük durumları yanlış değerlendirmelere ve tartışmalara yol açabilecektir. Denklik çalışmalarındaki gibi üst benzerlik sınırı yoktur ve bu alanda ortaya çıkan sonuçlar üstünlük deklare etmek için tek başına kanıt oluşturmazken olmadıkları da söylenemez.
Biyobenzerlere dair klinik çalışmalar değerlendirilirken tek başına klinik çalışmanın kendisiyle nihai kararların tartışmasını yapmaktan ziyade tüm geliştirme süreçlerini, amaçları, klinik araştırmalar yöntem ve tiplerini, ortaya konmak istenen hedefleri bütün olarak (totality of evidences) değerlendirmek gerekmektedir (2,42-45).
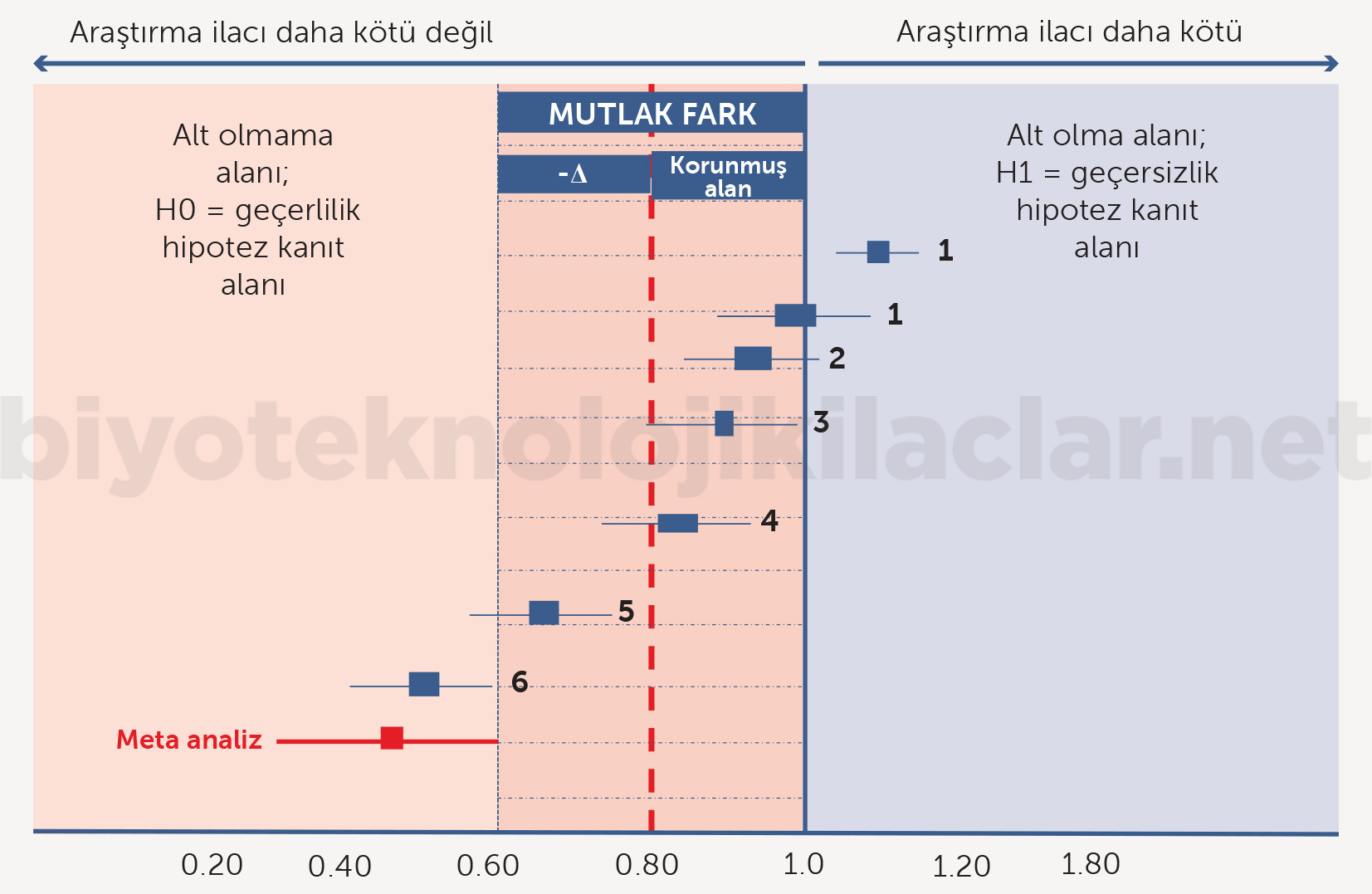
Şekil 15. Yeterlilik çalışmalarında alt sınır denklik çalışmalarına benzer şekilde hesaplanır. Ancak farklı olarak üst sınır yoktur. Çalışma sonuçları üstünlük ve denklik açısından tartışmalara daha açıktır. Bu nedenle biyobenzer Faz III çalışmaları metinde belirtilen şartlarda yeterlilik çalışması olarak tasarlanabilir. 1. Deneysel kol daha kötüdür. 2. Yeterlilik karşılanmamıştır ama alt sınır aralığı açısından tartışmaya açıktır. 3. Deneysel kol denklik sınırı içindedir ama daha kötüdür; tartışmaya açık bir bulgudur. 4. Deneysel kol alt değildir. 5. Deneysel kol istatistiksel olarak üstündür ama klinik olarak değildir. 6. Deneysel kol üstündür.
Günümüz koşullarında özellikle antikor yapısında büyük moleküllerde biyobenzerliğin gösterilmesi için Faz III çalışmaların yapılması zorunludur (1).
Örneklem Büyüklüğü
Örneklem büyüklüğüne dair genel yargı, denklik ve yeterlilik çalışmalarında örneklem büyüklüğünün üstünlük çalışmalarından daha fazla olduğu şeklindedir. Bununla birlikte, örneklem büyüklüğünde temel rol oynayan faktör tedavi etki büyüklüğüne dair olan beklentidir. Başka bir deyişle araştırma ilacıyla kontrol kolu tedavisi arasında öngörülen fark örneklem büyüklüğünü etkileyen temel değişkendir. Bir üstünlük çalışmasında araştırma kolundaki ilaç etkinliği yüksekse kontrol grubu ile arasındaki üstünlük farkını yeterli güç ve doğrulukta göstermek için daha küçük örneklem grubu yeterli olabilir. Ancak araştırma kolunda ilaç etki büyüklüğü sınırlıysa kontrol kolu ile arasındaki nispeten küçük farkı yeterli güç ve doğrulukta göstermek için daha büyük bir örneklem büyüklüğü gerekecektir.
Üstünlük çalışmalarına benzer şekilde, yeterlilik çalışmalarında alt benzerlik sınırı ve denklik çalışmalarında alt-üst benzerlik sınırları (-Δ ve +Δ değerleri) ne kadar darsa geçersizlik hipotezini reddetmek için örneklem büyüklüğünün o kadar büyük olması gerekecektir. Oysa Δ değerleri ne kadar genişse gereken örneklem büyüklüğü o kadar küçük olacaktır.
Tüm randomize çalışmalarda olduğu üzere Δ sınırının hesabı biyobenzer çalışmalarında da örneklem büyüklüğünün saptanmasında kritik role sahiptir. Biyobenzer çalışmalarında Δ büyüklüğüne bağlı olarak ortaya çıkan örneklem büyüklüğü bu çalışmaların zaman ve maliyetine de yansımaktadır. Dolayısıyla sağlık otoritelerinin ve ulusal / uluslararası düzenleyicilerin biyobenzer ilacın kendisi veya türünden beklentilere göre Δ sınırının büyüklüğüne karar vermesi durumu ortaya çıkmıştır.
Genel kural olarak Δ sınırının genişliği hiçbir zaman plasebo ile mutlak farkı ortadan kaldıracak ya da önemsizleştirecek kadar küçük olmamalıdır. Bu durum özellikle referans biyolojik ilacın etki büyüklüğünün zaten sınırlı olduğu durumlarda (mutlak fark aralığı dar) sorun olabilmektedir. Referans biyolojik ürün önceki tedaviye küçük bir farkla etkililik göstermiş ise bu küçük fark içinde mutlak farkın %50-70’inden daha dar aralıkta bir Δ değeri içinde denklik çalışmasıyla benzerlik gösterilmesi oldukça büyük örneklem büyüklüğü gerektirebilir ki bu da pratik bir yaklaşım olmayabilir. Bu durumda denklik çalışmasından ziyade daha küçük örneklem büyüklüğü gerektirecek yeterlilik çalışması ve/veya sağlık otoritelerinin referans ürüne genel bir benzerlik sınırı olarak kabul edilecek %15-20 oranında bir Δ önerisi kullanılabilir (42-47).
Veri Analizleri
Tedavi amacıyla çalışmaya dahil edilen tüm hasta grubu (intention to treat, ITT)
Prospektif randomize çalışmalarda tedavi kollarına randomize edilen tüm hastaların istatistiksel analize dahil edilerek hesaplamaların yapılmasına Intention To Treat (ITT) analizi denir. ITT analizinde tüm hastaların randomize edildiği kolda tedaviyi alabilmesinden veya çalışma protokolüne devam edip etmemesinden bağımsız olarak analiz yapılır. ITT analizi randomize edilen tüm hastaları analize dahil ederek tedavi grupları arasındaki prognostik dengeyi korumuş olur. Bu analizde tedavi protokolünün etkin uygulanıp uygulanmadığından bağımsız bir şekilde sonuç üretilir. Deneysel kolda tedavinin yeterince uygulanamadığı hastalara bağlı ortaya çıkabilecek bir başarısızlık durumu aslında gerçek dünyada da bu tedavinin uygulanabilirliği ve etkililiğinin tüm hastalara yansımasının bir sorun olacağı şeklinde düşünülebilir. ITT analizleri üstünlük çalışmalarında tercih edilen analiz yöntemidir. ITT analizinin sonuçlarında yeni tedavi seçeneğinin hem etkililiği hem uygulanabilirliği hem de tedaviye uyumun sonucu test edilmiş olur (4,5,42-45).
Protokolün uygulandığı ve yeterli tedavi alabilen hasta grubu analizi
(Per Protocol, PP)
Çalışma kollarına randomize edilen hastalar içinde sadece çalışma protokolüne uygun tedavi alan ve çalışmaya devam eden hastaların istatistiksel analize dâhil edilmesine Per Protocol (PP) analizi denir. Klinik çalışmalarda çalışma kollarına randomize edilen hastaların bir kısmına beklenmedik olaylar nedeniyle çalışma protokolü uygulanamayabilir. Çalışma protokolünün uygulanamadığı hasta grubu nedeniyle çalışma kolları arasındaki etkililik farkı doğru hesaplanmayabilir. Dolayısıyla kollar arasında protokole uyum sorunu nedeniyle sonuçlarda sapma olabilir. PP analiz tedavi etkililiğinin protokole uyum sorunları nedeniyle oluşacak hesap sapmalarından korunmasını sağlar. Yeterlilik ve denklik çalışmalarında tercih edilen ya da ITT analizi ile birlikte değerlendirilmesi gereken bir analiz olarak öne çıkmaktadır (5,41).
Biyobenzer çalışmalarında PP analizleri özellikle önemlidir. Biyobenzerlik kavramı içerisinde yürütülen Faz III klinik çalışmalarda aslında yeni bir ilacın denklik ya da yeterlilik çalışması yapılmaktan ziyade, preklinik ve FK/FD çalışmalarla zaten karşılaştırmalı olarak benzerliği önemli ölçüde gösterilmiş biyobenzer ürünün prospektif randomize kontrollü bir çalışmada olası rezidüel belirsizlikleri de ortadan kaldıracak bir benzerlik çalışması yapılmaktadır. Bu durumda, randomize edilen ama klinik araştırma protokolünün uygulanamadığı hastaların analize dahil edilmesi tedavilerin etkililiğini ölçmede karışıklığa neden olabilecektir. Üstünlük çalışmalarından farklı olarak biyobenzer çalışmalarında tedavi kollarına uygulanan her iki ilacın uygulanabilirlik gibi durumlarda farklı olmayacağı ve prognostik dengelemenin de iki ayrı ilacı değerlendirmeden daha farklı bir konumda olması nedeniyle ITT analizi PP analizine önceliklendirilemez.
Biyobenzer çalışmalarında diğer denklik ve yeterlilik çalışmalarında olduğu gibi PP ve ITT analizlerinin uyumlu olması beklenir. Seçilen birincil sonlanım noktası için geçersizlik hipotezinin reddinde PP ve ITT analiz sonuçlarının birlikte kullanılması ve bir uyumsuzluk durumunda üreticiyle otoritelerin sonuçları tartışarak değerlendirmesi gerekir (5,42).
Sonlanım Noktaları
Hem Faz I çalışmalarda hem de Faz III çalışmalarda klinik sonuçlarının benzer olması beklenen iki yüksek benzer molekül arasındaki rezidüel belirsizliği en hassas şekilde ortaya koyabilecek sonlanım noktaları birincil sonlanım noktası olarak belirlenir. Dolayısıyla yeni geliştirilmiş orijinal moleküllerle yapılan çalışmalardaki klasik sonlanım noktaları biyobenzer çalışmalar için benzerliği ya da rezidüel farkı ortaya koymak için yeterince duyarlı olmayabilir. Biyobenzer çalışmalarında seçilen sonlanım noktasının, hem hastalığın klinik seyrine ilacın etkisini gösterecek hem de iki ilacın etkililik ve güvenlilik farkını ortaya koyacak duyarlılıkta olması gerekir. Örneğin onkoloji çalışmalarında genel sağkalım ve progresyonsuz sağkalım, Faz III çalışmalarda en sık kullanılan birincil sonlanım noktalarıdır. Oysa bu parametreler ilacın direkt etkisi dışında hastalık yükü ve hastaya ait faktörler, önceki ve sonraki tedaviler gibi başka parametrelere de bağlı olduğundan yüksek benzer iki molekül arasındaki minimal belirsizlikten kaynaklanabilecek farkları ortaya koymak için yeterince duyarlı ve özgün olmayabilir. Onkoloji Faz III çalışmalarda nadiren birincil sonlanım noktası olan tümör yanıt oranları ise genel sağkalım ve progresyonsuz sağkalımdan daha fazla ilacın direkt etkisini yansıtan ve hastalığın gidişatını öngörebilen bir parametre olduğu için biyobenzer çalışmalarında birincil sonlanım noktası olarak kabul edilmektedir (1,2,5,42-45,51).
İnflamatuvar hastalıkların tedavisinde kullanılan ilaçların klinik etkililiğini değerlendirmede hastalık aktivitesini ölçmeyi içeren kompozit (composite) ölçümleri de kapsayan çok sayıda değerlendirme yapılır. Rituksimab biyobenzerinin romatoid artritli hastalarda etkililik ve güvenliliğinin değerlendirildiği bir çalışmada birincil sonlanım noktası 28 eklemde hastalık aktivite skoru (the disease activity in 28 joints score, DAS28) seçilmiştir. DAS28 romatoid artrit hastalık aktivitesini değerlendirmek ve rituksimab + metotreksat tedavilerini de içeren klinik çalışmalarda kompozit sonlanım noktası olarak geçerliliği doğrulanmış bir sonlanım noktasıdır. DAS28 potansiyel biyobenzerler için de hassas bir sonlanım noktası olarak belirlenmiştir (26–32). Yirmi dördüncü haftada başlangıca göre DAS28’deki değişimin denklik sınırı biyobenzer çalışmalarında kullanılmaktadır. FDA yeterlilik çalışmaları için tarihi verilerin etkililik ortalamasının en az %50 korunmasını önermektedir. Biyobenzer çalışmaları içinde simetrik alt ve üst sınırı yeterlilik çalışmaları için önerilen en az %50 etkinlik koruma ile belirlenerek yapılagelmektedir (44).
Hassas Homojen Popülasyon
Biyobenzerliği göstermek için denklik çalışmaları yapılmaktadır. Bunun için terapötik endikasyonlar arasından hassas birincil sonlanım noktasına dair iyi belirlenmiş denklik sınırları ve güvenirlik derecesiyle örneklem kitlesi belirlenir. Daha önce bahsedilmiş olan denklik çalışmasının bu ana özelliklerinin yanı sıra hem seçilecek sonlanım noktası hem de bu sonlanım noktasında sonuçları en hassas şekilde yansıtacak endikasyon ve hasta grubunda çalışma yapılması gerekir. Uygun hasta grubunun seçilmemiş olması çalışma sonuçlarının güvenirliğini etkileyecek temel faktörlerdendir. Özellikle onkoloji alanında mAb’ların hemen hepsi kemoterapi rejimlerine ek olarak kullanılır. Aynı mAb farklı veya aynı endikasyonlarda farklı kemoterapi rejimleriyle kullanılabilmektedir. Referans bir mAb aynı tümör tipinde kullanılsa da farklı kemoterapi kombinasyonları ve farklı hasta gruplarında araştırıldığı için yanıt oranları belirgin farklılıklar gösterebilmektedir. Dolayısıyla yanıt oranını güvenilir şekilde ortaya koyacak uygun endikasyon ve buna bağlı hasta grubu önemlidir. Örneğin bevasizumab onkolojide çok sayıda tümör tipinde, farklı tedavi basamaklarında ve farklı kombinasyonlarla kullanılmaktadır. Karboplatin / paklitaksel gibi daha standart bir tedaviyle birincil sonlanım noktası olarak yanıt oranlarını almış yeterli çalışmaları olan küçük hücreli dışı nonskuamöz ileri evre akciğer kanserinin birinci basamak tedavisinde biyobenzer bevasizumab araştırılması genel kabul görmektedir. Dolayısıyla referans ve biyobenzer bevasizumab arasındaki rezidüel farkları en hassas yansıtacak hasta popülasyonu ileri evre küçük hücreli dışı nonskuamöz akciğer kanserli hastalardır. Daha önceki tedavilerden etkilenmemiş, genel durumu ilaç etkililiğini en iyi yansıtacak özellikteki birinci basamak tedavi alacak ve sağlık durumu iyi hastalar hassas ve homojen hasta grubunu yansıtmaktadır. Bevasizumabın en sık kullanıldığı ileri evre kolon kanserinde hastalık seyri ve hastalık yüküne göre daha heterojen bir hasta grubu olması, aynı kemoterapi protokollerinin dahi uygulamasındaki farklılıklar, çalışmalara seçilmiş hasta gruplarının farklılıkları ileri evre kolorektal kanserli hasta grubunu hassas ve homojen hasta grubu olarak tanımlanmasına engel gözükmektedir (2,5,42-45,52).
Homojen hasta popülasyonu tanımı farklı ilaçlarda daha tartışmalı olabilmektedir. Örneğin, EMA ve FDA biyobenzer trastuzumab için yanıt oranlarını değerlendirmede birinci basamak tedavi edilecek ileri evre meme kanserli hastaları hassas popülasyon olarak kabul etmektedir. Bununla beraber, onkoloji pratiğine oldukça yerleşmiş meme kanserinin neoadjuvan tedavisinde tam yanıt oranları da hassas birincil sonlanım noktası kabul edilmektedir (Tablo 3). Neoadjuvan tedavi alacak olan hastaların hastalık yükü ve süreci açısından daha homojen bir hasta grubu oluşturacağı ifade edilmektedir. Hassas homojen hastalık ve hasta grubu meme kanseri için bir tartışma olagelmekle birlikte, tüm biyobenzer trastuzumab geliştirme sürecinde ve metastatik hastalıkta heterojeniteyi minimize edecek çalışma tasarımı ve gücüyle biyobenzerliğin gösterilmesi için yeterli bilimsel kanıt ortaya konmaktadır (52).

Romatolojide de onkolojiye benzer şekilde ilaca özgün olarak seçilen hassas birincil sonlanım noktasında en çok değerlendirilebilir çalışması olan ve en iyi değerlendirilebilir homojen hasta grubu biyobenzerler için hassas homojen hasta grubu olarak tanımlanmaktadır. Örnek olarak metotreksat ile rituksimab kombinasyonu almaya aday romatoidli hasta grubu hassas birincil sonlanım noktası olarak kabul edilen DAS28’deki değişikliğin değerlendirileceği romatoid artritli hastalar kabul edilmektedir. Bununla beraber, hem biyobenzer adalimumab hem de biyobenzer etanersept çalışmalarında psöriatik artritli hasta grubunun da çalışma popülasyonu olarak belirlendiği görülmektedir. EMA’nın romatoid artiriti psöriatik artrite tercih etmesine rağmen üreticilerin yeterli gerekçe ve analizle sonuçlarını sunması onay süreçlerini başarıyla tamamlamalarını sağlamıştır (5,44).
Hem onkoloji hem de romatoloji alanındaki örnekler göstermektedir ki çalışmalar için tercih edilen ve önerilen hasta tanımları ve özellikleri olmasına rağmen yeterli gerekçe ve kanıtla üretici ve otoriteler dinamik ve esnek bir süreç işletmektedirler.