İÇİNDEKİLER
- Önsöz
- Giriş
- Biyoteknolojik İlaçlar ve Üretim Süreçleri
- Biyobenzer İlaçlar ve Karşılaştırılabilirlik
- Biyobenzer Ürünlerde Ekstrapolasyon
- Biyobenzer İlaçlarda Değiştirilebilirlik
- Biyoüstünler
- Referans Ürünle Yeterli Karşılaştırma Çalışması Olmayan Biyolojik Ürünler
- Biyolojik ve Biyobenzer İlaçlarda Farmakovijilans, İzlenebilirlik ve Risk Yönetimi
- Yazarlar
BİYOÜSTÜNLER
Prof. Dr. İrfan Çiçin
Son yıllarda biyoteknolojik ilaç endüstrisinin hızlı gelişmesi, sürekli yenilik arayışı içinde olması öncelikle biyobenzer, daha sonra biyoüstün kavramlarının, yeni ilaç kategorilerinin gelişmesine yol açmıştır.
Bu iki kategori aslında birbirinden tamamıyla farklı olmasına rağmen, bu iki ilaç grubunun aynı orijinal ilaçtan köken alması nedeniyle özellikle ilaç üreticileri tarafından benzer preklinik ve klinik çalışma muafiyetlerinin olması gerektiği görüşü yaygın tartışma konusudur.
Avrupa İlaç Ajansı (EMA), biyobenzerler için yasal, temel ve düzenleyici kılavuz hazırlayan ilk kurumdur. Avrupa Birliği'ndeki (AB) hastalar için yüksek standartta biyobenzer ilaçlar sağlamak amacıyla 2004'ten sonra bu kılavuzlar sürekli geliştirildi.
İlk kılavuzun yürürlüğe girmesinden sonra, bazı ülkeler biyobenzerleri yeni bir konsept olması nedeniyle günlük pratiğe dahil etmekte tereddüt yaşadı. Özellikle 2013’te, Avrupa biyobenzer pazarına Güney Koreli bir şirketin geliştirdiği ilk biyobenzer girince bu süreç hızlanmıştır. Bu süreç özellikle orijinal biyolojik ürünleri olan firmaları yeni bir yaklaşım geliştirmeye zorlamıştır ve rekabet amacıyla modifiye edilmiş orijinal biyolojikler geliştirilmeye başlanmıştır. Bir biyoüstün mevcut bir biyolojik ürünün geliştirilmiş versiyonu olarak düşünülebilir.
Biyobenzer kavramı açıkça tanımlanmış, evrensel bir terim olsa da “biyoüstün (biobetter, biosuperiors)” halen evrensel olarak kabul görmüş değildir ve bir pazarlama terimi olarak kabul görmektedir.
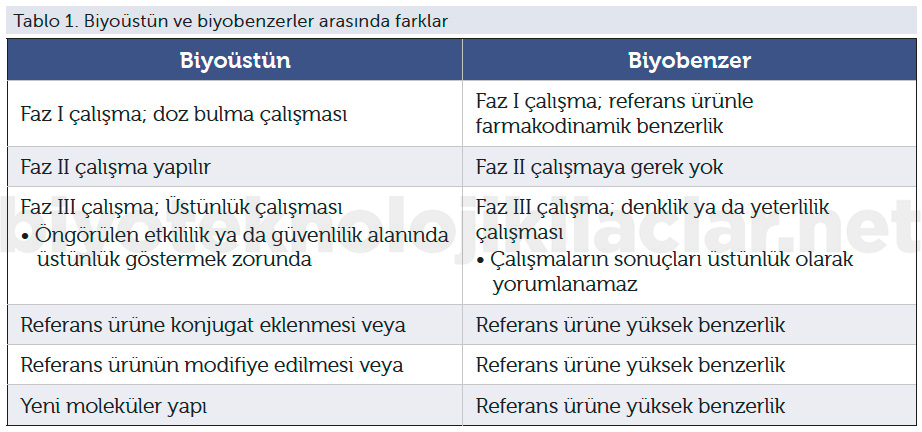
Biyoüstün ilaçlarda asıl biyolojik ilaca göre, yapıda veya formülasyonda bir değişiklikle:
1. Daha etkin,
2. Daha güvenli (daha az toksik, immünojenisite riski azalmış),
3. Daha az tedavi kürü sıklığı gerektiren (yavaş veya sürekli salınım formları)
4. Daha tolere edilebilir biyolojik ilaçlar geliştirilebilir.
Biyoüstünler orijinal biyolojik ürünlerin yükseltilmiş sürümleri gibi algılansa da ilaç otoriteleri biyoüstünleri yeni ürünler olarak kabul etmektedir. Bu nedenle herhangi bir orijinal ilaç gibi patent koruması sağlanmaktadır. Bu korumanın olabilmesi için klinik ve klinik olmayan veri paketleri, orijinal ilaçla karşılaştırma sonuçları gereklidir. Halen yeni ilaç olarak değerlendirilen biyoüstünler için ilaç geliştirmek isteyen firmalar orijinal biyolojikle moleküler benzerlik sebebiyle daha kısa başvuru ve ruhsat aşamaları istemektedir.
Biyobenzerler, özellikle Avrupa Birliği ve ABD dışındaki ülkelerde, “biyolojik jenerik” olarak algılanmaktadır. Başlangıçtaki biyolojik ilaç kopyalarının orijinal ile aynı olabileceği düşünülmüş, ancak yeni bir işlem kullanılarak üretildiğinden, ayrıntılarda farklı yapılara ve bazı farklı etkilere sahip olabileceği gözlenmiştir. Bu nedenle kimyasal ilaçtan farklı olarak biyobenzerler için de ciddi klinik çalışmalara gereksinim olmuştur. Biyoüstünler için durum daha da farklıdır. Orijinal moleküle temelde bazı benzerlikler göstermekle beraber, asla kopya ve jenerik olarak düşünülmemelidir.
Biyoüstünler, mevcut biyolojiklerle hedef veya eylem yoluyla ilişkili olan yeni moleküller olmakla beraber, kullanım, güvenlilik, etkililik veya üretim özelliklerini geliştirmek için orijinalden bilerek, planlanarak değiştirilmiştir. Bu nedenle ciddi, kapsamlı yeni klinik çalışmalarla değerlendirme gereklidir.
Biyoüstünler için preklinik geliştirme aşamaları da klinik geliştirme aşamasından farklı değildir. Preklinik inceleme evrelerinin de yeni ilaç gibi algılanması söz konusudur. Bu nedenle bu çalışmalarda maliyet ve süre açısından bir azalma veya muafiyet söz konusu değildir. Preklinik çalışmanın yeni ilaçta aynı kalite, kapsam ve yapıda olması beklenmektedir.
Önemli örneklerden biri toksik olmayan, immünojenik yanıt oluşturmayan polimer niteliğindeki polietilen glikol (PEG) ile biyolojik bir molekülü modifiye etme işlemi yani PEGilasyondur. Bu işlem, biyolojik molekülün özelliklerini, örneğin ilaç stabilitesini (raf ömrünü) ve ilaç uygulama sıklığını azaltmak için değiştirmek amacıyla yapılır. İlk biyobenzerleri çıkan epoetin beta ve filgrastim’in daha sonra orijinal biyolojik ilaç sahibi firma tarafından PEGile formları (metoksi polietilen glikol-epoetin beta) ve biyoüstün (pegfilgrastim) piyasaya çıkmıştır. Her iki ürün de etkililiği azaltmadan dozaj sıklığını azaltmak amacıyla geliştirilmiştir.
Biyoüstünlere ilaç otoritelerinin ve geri ödeme kurumlarının bakış açısı da değişkendir. Örneğin, İngiltere’de NICE uzun müddet kılavuzlarda eritropoietik uyarıcı ajanlar arasında etkililik açısından fark olduğuna dair bir kanıt olmadığını belirtmiştir. Fransa’daki “Haute Autorité de Santé (HAS)” PEGile epoetin betanın daha uygun olmasına rağmen morbidite veya hastanın yaşam kalitesi üzerinde herhangi bir ek etkisinin olmadığını geri ödemede göz önünde bulundurmuştur. İlaç üreticileri bu yorumlar karşısında bu alanda özellikle “Etkililik her şey değildir” anlayışını ön plana çıkarmaya çalışmaktadırlar.
Bir molekülü değiştirmek için başka bir yöntem de iki ilacı bir araya getiren biyomühendislik yaklaşımıdır. 2000 yılında, Trastuzumab, HER2 pozitif metastatik meme kanserinde kullanım için ilk AB onayını alırken, 2013 yılında (trastuzumab, emtansin), HER2 pozitif ileri derece metastatik meme kanseri için ilk AB onayını aldı. Kadcyla, Herceptin ve Emtansin’in biyomühendislik ile birleştirilmiş halidir. Genel yaklaşım tedaviye cevap vermeyen hastalar için ikinci basamak bir tedavi olarak Kadcyla’nın kullanımıdır.
Gazyva (obinutuzumab) ve Rituxan (rituksimab) B lenfositlerin yüzeyinde eksprese edilen CD20 antijenini hedef alır. Gazyva ve Rituxan’ın çeşitli karşılaştırmalarında Gazyva bazı çalışmalarda üstün etkinlik göstermiştir. Ancak bazı çalışmalarda toksisite riski daha yüksek saptanmıştır.
Yukarıdaki örnek ve anlatımlardan anlaşılmaktadır ki biyoüstün ilaç örnekleri referans bir ilaç baz alınarak, yeni bir formülasyon, yeni bir konjugat ürün veya molekül yapısıyla oynanarak yeni bir molekül elde edilmesi durumlarını tariflemektedir.
Elde edilen yeni ürünün elde edilme gerekçesine uygun şekilde üstünlük çalışmalarıyla etkliliğinin ya da güvenliliğinin gösterilmesi gerekir. Biyoüstünler doğası gereği üstünlük çalışmalarıyla uygulamaya girme olanağı bulabilir. Konjugat yapısındaki ilaçların biyoterapötik parçası biyobenzer olabilir. Ancak bu biyobenzer molekülün amacı yeni konjugat ürün bileşimiyle birlikte biyoüstünlüktür. Trastuzumab derukstekan buna tipik bir örnektir. Konjugat ürünlerin de biyoüstünlük gösterilebilmesi için Faz I, Faz II ve Faz III çalışmalarla etkililiğin ve güvenliliğin gösterilmesi gerekir.
Biyoüstünlerin aksine biyobenzerlerde amaç referans ürüne benzer olduklarının gösterilmesidir. Geliştirilme süreçlerinde ortaya çıkan bilgi birikim ve deneyimlerle immünojenisite gibi alanlarda avantajlara sahip olabilir (Etanersept). Ancak unutulmamalıdır ki referans üründe de zaman içinde uygulama ve güvenlilik gibi konularda iyileştirici müdahaleler yapılabilir.
KAYNAKLARBiyobenzerlerin yeterlilik ya da denklik çalışmalarında ortaya çıkabilecek biyobenzer lehine anlamlı ikincil sonlanım noktası, alt grup ve güvenlilik sonuçlarındaki üstünlük bulguları çalışmaların amacı ötesinde üstünlük olarak yorumlanmamalıdır. Bu bulgular tip I ve tip II hatalara açıktır ve hekimlerin hasta yönetim sürecinde tercihlerine katkı sağlamasının ötesinde bir bulgu olarak değerlendirilmemelidir.