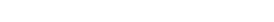İÇİNDEKİLER
- Önsöz
- Giriş
- Biyoteknolojik İlaçlar ve Üretim Süreçleri
- Biyobenzer İlaçlar ve Karşılaştırılabilirlik
- Biyobenzer Ürünlerde Ekstrapolasyon
- Biyobenzer İlaçlarda Değiştirilebilirlik
- Biyoüstünler
- Referans Ürünle Yeterli Karşılaştırma Çalışması Olmayan Biyolojik Ürünler
- Biyolojik ve Biyobenzer İlaçlarda Farmakovijilans, İzlenebilirlik ve Risk Yönetimi
- Yazarlar
BİYOTEKNOLOJİK İLAÇLARIN ÜRETİMİ
Biyoteknolojik ilaçların üretiminde rekombinant DNA teknolojisi kullanılmaktadır. Rekombinant DNA teknolojisi, rekombinant DNA molekülü oluşturabilmek için kullanılan yöntemler serisi olup; bir gen parçasının klonlanması ve klonlanan genden protein ekspresyonu işlemidir.
Gen teknolojisindeki gelişmeler ile genlerin hücreler içerisine aktarımı mümkün olabilmektedir (24). Biyoteknolojik ilaçların üretimi kontrollü ve sınıflandırılmış alanlarda cGMP kuralları çerçevesinde gerçekleştirilir. Rekombinant protein üretim basamakları aşağıda verilmiştir (25,26).
- İstenen farmasötik proteini üretebilecek hedef gen dizisi seçilir ve çoğaltılır.
- Hedef gen dizisi ve ekspresyon vektörü aynı restriksiyon enzimi ile kesilir.
- Hedef gen dizisi ekspresyon vektörüne klonlanarak rekombinant DNA molekülü oluşturulur.
- İstediğimiz rekombinant proteinin üretimini yapabilecek uygun bir konakçı hücre seçilerek, rekombinant plazmit DNA molekülü bu hücre içerisine aktarılır. Rekombinant DNA molekülünün hücre içine aktarılması işlemine, konakçı hücre bakteri hücresi ise ‘transformasyon’, memeli hücresi ise ‘transfeksiyon’ denir.
- Hedef proteinin ekspresyonu için pozitif klon içeren hücreler çoğaltılarak ana hücre bankası ve çalışma hücre bankaları hazırlanır.
- Hücre bankalarından hareketle, uygun üretim koşullarında fermantasyon ile hedef rekombinant proteinin ekspresyonu sağlanır.
- Ekspresyonu yapılmış hedef rekombinant protein saflaştırılır ve stabilitesinin sağlanması için uygun formülasyonu geliştirilir.
- Formülasyonu yapılmış proteinin hedeflenen konsantrasyonda primer ambalaj materyaline dolumu sağlanarak; rekombinant protein ilaç elde edilir.
Biyoteknolojik ilaçların üretiminde kullanılan gen klonlama sistemi DNA’yı taşıyan ve kendini eşleyip, çoğalabilmesini sağlayan bir ekspresyon vektörü ve vektörün kendini eşleyip, çoğalabildiği ekspresyon sisteminden (konakçı hücreden) oluşmaktadır.

Ekspresyon Vektörü
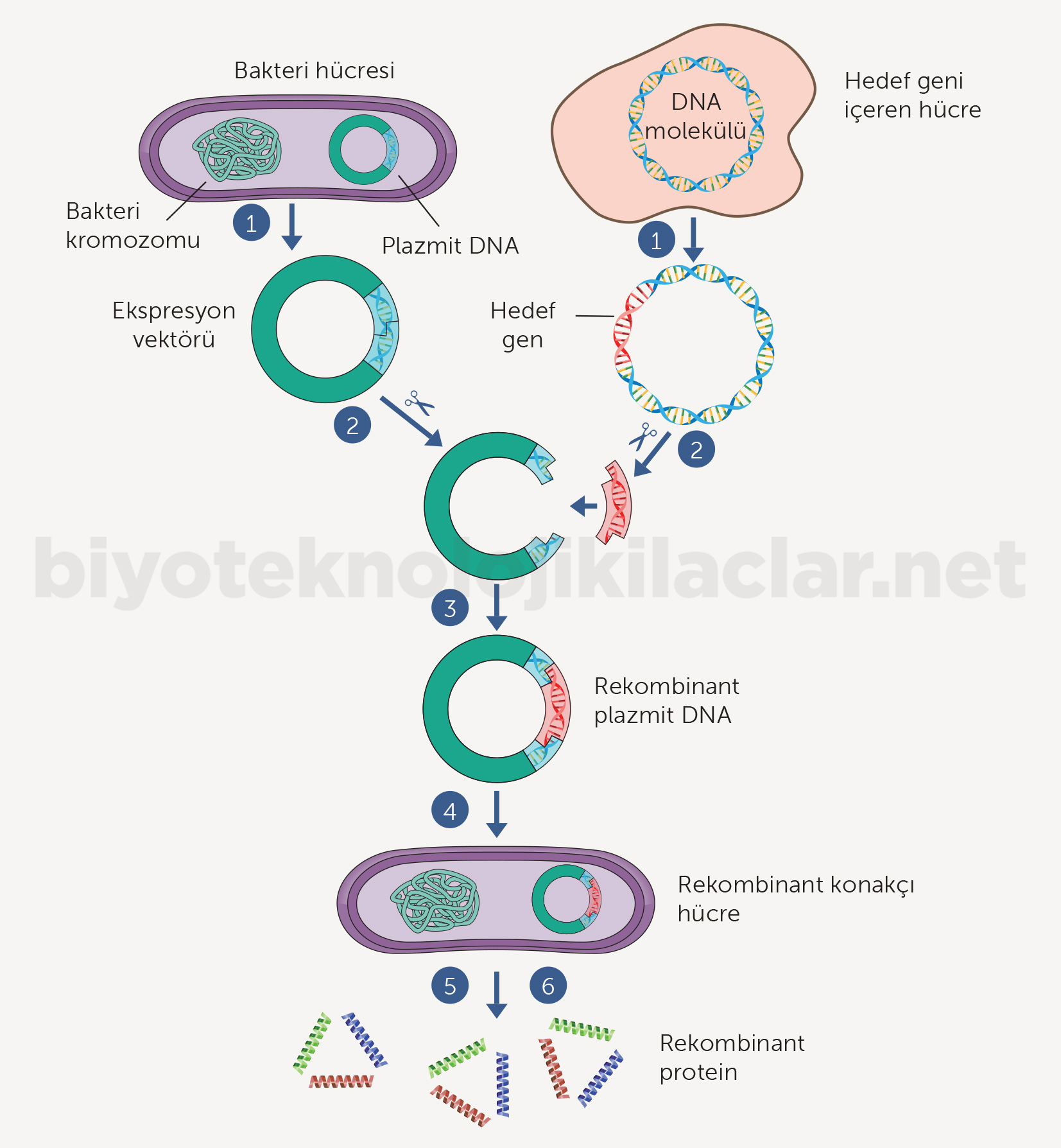
Ekspresyon vektörü hedeflenen gen parçasıyla birlikte maksimum gen ekspresyonunu sağlayabilmek için, çevrilme ve yazılım sinyalleri gibi önemli düzenleyici diziler içeren klonlama vektörüdür. Uygun konakçı hücrede kendilerini eşleyip çoğalabildikleri gibi, yabancı DNA parçasının kendisini eşleyip çoğalabilmesini de sağlarlar (27). Ekspresyon vektörünün uygun konakçı hücrede rekombinant protein ekspresyonu yapabilmesi için yapısında replikasyon merkezi, seçici belirteç gen, promoter bölge (yazılım ilerleticisi), Shine Dalgarno dizisi (SD), bildirici genler, proteaz kesim bölgeleri, çoklu klonlama bölgesi, stop kodonu gibi bazı parçaların bulunması gereklidir (Şekil 4) (28-30).
Rekombinant protein üretiminde kullanılan ekspresyon vektörleri aşağıda verilmiştir (31,32).
- Plazmitler
- Bakteriyofajlar
- Kozmitler
- Yapay Maya Kromozomu
- Yapay Bakteri Kromozomu
Replikasyon Merkezi: Plazmit DNA kopya sayısını kontrol eder. Kopya sayısı plazmit DNA stabilitesini etkilemektedir. İyi bir gen ekspresyonu için plazmit DNA kopya sayısı yüksek olmalıdır (33).
Seçici Belirteç Gen: Seçici belirteç genler antibiyotik direnç genleridir. Plazmit DNA üzerinde antibiyotik direnç genleri bulunduğunda, antibiyotikli büyüme ortamında plazmit DNA içeren hücreler çoğalır, içermeyen hücreler çoğalamaz. Bu amaçla en çok kullanılan antibiyotikler Ampisilin, Kanamisin, Tetrasiklin, Kloramfenikol ve Rifampisin’dir.
Promoter Bölge (Yazılım İlerleticisi): Ribozom bağlanma bölgesinin 10 - 100 nükleotit yukarısındadır ve yazılımı başlatır. İdeal bir promoter toplam hücresel proteinin
%50’sinden fazla ürün sağlayabilecek kadar güçlü olmalı, düşük bazal ekspresyon seviyesine sahip olmalı, kolay indüklenebilir ve ucuz olmalıdır (33).
Shine Dalgarno(SD) Dizisi: Çevrilmenin başlaması için gereklidir. Ribozomların mRNA dizisi üzerinde bulunan Ribozomal Bağlanma Bölgesi içindeki Shine Dalgarno dizilerine bağlanmasıyla çevrilme başlar. 16S Ribozomal RNA’nın 3’ ucu ile komplementerdir. SD dizisi UAAGGAGG olduğunda optimum çevrilme olmaktadır. Bağlanma bölgesi ve başlama kodonu arasındaki uzaklık 4-8 aa uzunluğunda olmalıdır (33).
Taglar ve Füzyon Proteinleri: Heterolog proteinler küçük peptitlere (taglara) veya diğer proteinlere (füzyon partnerlerine) N- veya C– terminalden eklenebilir.
Füzyon proteinlerinin ve tagların çeşitli avantajları bulunmaktadır (34).
Bunlar:
- Ekspresyonun sağlanması
- Çözünürlüğün sağlanması
- Saflaştırılmanın sağlanması
- İstenen proteinin tayin edilmesi
Bildirici Genler: İlgili genin hücre içerisine alınıp alınmadığını ve ekspresyonunun yapılıp yapılmadığını tayin etmek için kullanılan genlerdir. Sıklıkla kullanılan bildirici genler Yeşil Floresans Protein (GFP), Kırmızı Floresans Protein (RFP), Lusiferaz enzimi, LacZ ve CAT genleridir (35).
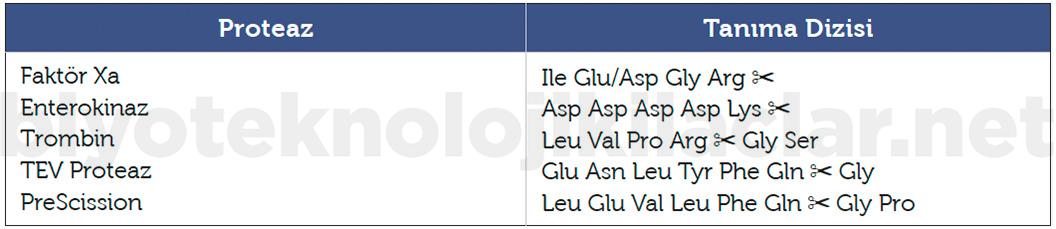
Proteaz Kesim Bölgeleri: Tag veya füzyon partnerinin ekspresyondan sonra füzyon proteininden ayrılması için eklenirler (33).
Tablo 4. Proteaz enzimleri kesim bölgeleri
Çoklu Klonlama Bölgesi: Vektör üzerinde çeşitli diziye özgül endonükleazların bulunduğu bölgedir. Diziye özgül endonükleazların varlığı sayesinde, ilgili gen çoklu klonlama bölgesinden vektöre klonlanır.
Stop Kodonu: Çevrilmenin sonlandırıldığı noktadır. TAA, TAG ve TGA olmak üzere 3 çeşit stop kodonu vardır.
Ekspresyon Sistemi
Ekspresyon sistemi, üretimi yapılması istenen rekombinant proteine ait gen dizisini içeren ekspresyon vektörünün kendisini eşleyip çoğalabildiği konakçı hücredir. Rekombinant protein üretiminde kullanılan konakçı hücreler aşağıda verilmiştir (36-39).
o Prokaryotik hücreler (Escherichia coli, Lactococcus lactis, Bacillus sp. vb)
o Mayalar (Saccharomyces cerevisiae, Pichia pastoris, Pichia methanolica)
o Memeli hücreleri (Çin Hamster Over (CHO) hücreleri, vb)
o Böcek hücreleri
o Transgenik hayvanlar (koyun, keçi, domuz, fare, inek)
o Transgenik bitkiler (tütün, ayçiçeği, patates, pirinç)
Konakçı hücrelerin özellikleri birbirlerinden farklılık göstermektedir. Konakçı hücre seçiminde ekspresyonu yapılması istenen proteinin özellikleri önem taşımaktadır. Monoklonal antikorlar, büyük proteinler, konformasyonel stabilite için pek çok disülfit bağı içeren ve glikozilasyon gerektiren proteinler için memeli ekspresyon sistemi seçilmelidir. Ayrıca proteinin seçilen hücre içerisine çözünür bir şekilde salgılanıp salgılanmadığı da saflaştırma açısından önem taşımaktadır. Konakçı hücre, ekspresyonu yapılan protein ürününün özelliklerini belirlemektedir (20,40-43).
Hücre Bankalarının Oluşturulması
Üretim basamağından önce hücre hattının geliştirilmesi kritik bir basamaktır. Üretimi yapılması istenen farmasötik proteinin ekspresyonunu yapabilecek ekspresyon vektörü (genellikle plazmit DNA), hücreler içerisine aktarılarak, hücre bankaları oluşturulur. Hücre bankalarının İyi Üretim Uygulamaları (Good Manufacturing Practice-GMP) sertifikaları bulunmalıdır. Farmasötik proteinlerin üretimi için kullanılacak hücre bankalarının karakterizasyonlarının çok iyi bir şekilde yapılmış olması gerekir. Hücre bankalarının kalite kontrolünün yapılabilmesi için canlılık, tanıma, saflık, genetik stabilite, sterilite, mikoplazma, beklenmedik virüsler ve retrovirüs açısından değerlendirilmeleri gereklidir (44).
Ana hücre bankası (Master cell bank)
Ana hücre bankası(AHB) EMA’da ‘Genellikle seçilen bir hücre klonundan tanımlı koşullar altında hazırlanan, birçok kaba bölünen ve tanımlı koşullar altında saklanan, tek bir hücre havuzunun bir bölümü’ olarak tanımlanmıştır. Bir ana hücre bankası, hücre hattı gelişiminin “son noktası” olan bir araştırma hücre bankasından hazırlanmaktadır (44). Ana hücre bankası, tek bir işlemle kaplarına dağıtılmış, tekdüzeliği sağlayacak şekilde işlenmiş ve stabilitesi garanti altına alınacak şekilde saklanmış, tamamen karakterize edilmiş hücre kültürüdür (45). Ana hücre bankası çalışma hücre bankalarını hazırlamak için kullanılır (44-46). Ana hücre bankası depolanmak amacıyla birden çok saklama kabına dağıtılır ve bölünen parçalar ayrı yerlerde muhafaza edilmek koşuluyla -70 °C veya daha düşük sıcaklıklarda saklanır (45,46).
Çalışma hücre bankası (Working cell bank)
Çalışma hücre bankası(ÇHB), ana hücre bankasından üretim hücre kültürleri hazırlamak amacıyla türetilmiş; stabilitesi ve üretim için kullanılabilirliği sağlanacak biçimde saklanmış bir ana hücre bankasının tanımlı kültür koşulları altında çoğaltılmasından elde edilen homojen hücre kültürüdür (44,45). Çalışma hücre bankası depolanmak amacıyla birden çok saklama kabına dağıtılır ve bölünen parçalar ayrı yerlerde muhafaza edilmek koşuluyla -70°C veya daha düşük sıcaklıklarda saklanır (45,46).
Üst Akım İşlemleri (Upstream Process)
Üst akım, hücrelerin üretim biyoreaktörü için hazırlanması amacıyla inokulum çoğaltma aşamasıyla başlayan süreçtir. Fermantasyon, biyofarmasötikleri üretmek için hücre bankalarından hareketle hücrelerin çoğaltıldığı üst akım sürecinin bir parçasıdır. Fermantasyon teknolojisinde biyofarmasötiklerin üretilmesi için kullanılan reaktörler biyoreaktör olarak adlandırılır. İstenen özelliklerdeki hücrelerin taranması ve seçilmesinin ardından ana hücre bankası oluşturulur. Ana hücre bankasından hareketle hazırlanmış ve dondurularak saklanmış çalışma hücre bankası ampulü çözündürülerek hücre kültürü şişesine aktarılır ve çalkalama şişeleri, hücre torbaları ve tohum biyoreaktörlerinde çoğaltılır. Biyoreaktörler ile hücrelerin çoğalması, büyümesi ve üretim verimini doğrudan etkileyen oksijen, pH, substrat, ozmotik basınç, sıcaklık, karıştırma hızı gibi parametreler ayarlanarak; optimum verimde doğru ürün elde edilmesi sağlanır.
Kültür ortamı ve hücre büyümesi şartlarının proteinin glikozilasyonu üzerine, glikozilasyon derecesinin de proteinin immünojenisitesi, saflığı ve etkililiği üzerine önemli bir etkisi vardır. Donmuş hücre bankalarından kesikli veya sürekli kültür sistemine ölçek büyütme çok basamaklı ve kritik bir işlemdir.
Ölçek büyütme sırasında meydana gelen en ufak değişiklikler, üretim ortamına tanımlanmamış ve uzaklaştırılmamış farklı safsızlıkların gelmesine ve ürün varyasyonlarına neden olur.
Üretim için memeli hücreleri kullanıldığında proteinin yapısal özelliklerini kültür ortamı belirlemektedir. Üretim için bakteri hücreleri kullanıldığında proteinin yapısal özellikleri saflaştırma sırasında belirlenmektedir. Uygun kültür ortamında üretimi yapılan protein hasat edilerek, alt akım işlemlerine geçilir (47-50).
"Biyofarmasötiklerde üretim süreci ürünün kendisidir. Aynı ürünün üretiminde dahi, her üretim serisinde birbirine benzer; ancak birbirinden farklı ürünler oluşur. Hedef ürün kalite profili için üretim, saflaştırma ve formülasyon sürecindeki kritik işlem parametreleri belirlenmeli ve kontrol altına alınmalıdır (51,52). Biyoteknolojik ürünlerde bu kritik işlem parametrelerinin başlangıçta belirlenmesiyle bu süreç kontrol altında tutulur. Üretim, İyi Üretim Uygulamaları (GMP) kuralları çerçevesinde yapılmalıdır. Üretim ekipmanı olarak paslanmaz çelik sistemler ve/veya tek kullanımlık sistemler kullanılabilir (53)."
Alt Akım İşlemleri (Downstream Process)
Alt akım işlemleri, istenen ürünün amaçlanan kullanıma uygun hale gelmesi için yapılan ayırma ve saflaştırma işlemleridir (49). Hasat sonrası üretimi yapılan proteinin ortamdan saflaştırılması gerekmektedir.
Saflaştırma basamağı üretimin kritik bir basamağıdır.
Üst akım işlemlerinden (besiyeri ortam bileşenleri, hücre artıkları, vb) ve alt akım işlemlerinden gelen safsızlıklar (tampon, reçine, vb) ürünün biyoaktivitesini ve immünojenisitesini değiştirebilir. Bu nedenle safsızlıkların farmakopelerin ve kılavuzların kabul ettiği limitler dahilinde olması gereklidir (54).
Memeli hücreleri kullanıldığında, saflaştırma işlemiyle konakçı hücre proteinleri, DNA, ortam bileşenleri, virüsler ve metabolik yan ürünler uzaklaştırılır. Saflaştırma işlemi sırasında proteinin uygun glikozilasyon yapmış formları seçilerek, yanlış katlanmış ve agregasyona uğramış formları uzaklaştırılır.
Biyobenzer ürünlerde hücre bankası sistemindeki ve üretim işlemleri sırasındaki farklılıklar nedeniyle referans tıbbi üründen farklı safsızlıklar gözlenir.
Saflaştırma basamağı sırasında hedef proteinin istenen izoformları saflaştırılır. Örneğin eritropoietinin yüksek biyolojik aktivite gösterebilmesi için büyük ölçüde glikozile olmuş izoformların saflaştırılması gerekmektedir (55,56).
Formülasyon
Saflaştırılan hedef protein yapısal bütünlük ve potens açısından analiz edildikten sonra, formülasyonu yapılır ve son ürün kabında ambalajlanır. Protein için uygun formülasyon geliştirme kritik bir basamaktır. Stabilitenin artması, immünojenisitenin azaltılması ve farmakokinetik / farmakodinamikle ilişkili problemlerin ortadan kaldırılarak dolaşımdaki yarı ömrün uzatılması için biyofarmasötiklerin formülasyonları dikkatle seçilmelidir (57,58). Formülasyondan sonra yapısal bütünlüğün ve biyoaktif konformasyonun korunup korunmadığı test edilmelidir. Sıcaklık, pH, eksipiyanlar, karıştırma / çalkalama, hava ve ışıkla temas, nem, kap kapak sistemi ve saklama koşulları protein yapısındaki ürünün stabilitesini değiştiren faktörlerdir (59,60).
Formülasyon bileşenlerinin, formülasyon yönteminin, bitmiş ürün primer ambalaj materyalinin ürünün stabilitesi ve terapötik etkinliği üzerine etkisi bulunmaktadır. Örneğin, eksipiyan (yardımcı madde) seçimi kronik hepatit C hastalarında kullanılan interferon-alfa 2a ilacının immünojenisitesini değiştirmiştir. Oda sıcaklığında saklanan interferon-alfa 2a flakonlarında, immünojenisite sebebi olan, eksipiyanlarla agregasyon gözlenmiş ancak buzdolabında saklanan flakonlarda agregasyon gözlenmemiştir. Formülasyondan eksipiyan olarak kullanılan insan serum albümininin çıkarılması ve soğuk zincir koşullarının sağlanmasıyla ürünün immünojenisitesi azaltılmıştır (61,62).
Ambalajlama
Biyoteknolojik ilaçların üretiminin son basamağı formülasyonu tamamlanmış ürünün ambalajlanmasıdır. Primer ambalaj materyali olarak genellikle borosilikat Tip 1 cam flakon veya kullanıma hazır enjektör kullanılır. Primer ambalaj materyali ile ilgili gereklilikler farmakopelerde ve kılavuzlarda mevcuttur (63).
Saklama sıcaklığı, saklama sırasında primer ambalaj materyali olarak kullanılan kap kapak sistemiyle ürünün etkileşimi kap kapak sisteminden gelen ekstrakte edilebilir (tüketilebilir) ve sızabilir maddelerin ortamdaki varlığı biyolojik ilaçların aktivitesi ve immünojenisitesini etkilemektedir (64).
Plastik veya kauçuk kap kapak sisteminden ortama sızabilen bileşenler potansiyel klinik alerjik reaksiyonlara neden olabilir. Örneğin; Epoetin alfa içeren kullanıma hazır enjektörde bulunan kaplanmamış kauçuk enjektör tıpasından süzülen maddeler saf kırmızı hücre aplazisi (PRCA) insidansını artırmıştır. Epoetin alfa içeren kullanıma hazır enjektörde kaplanmış kauçuk tıpanın kullanılması ise PRCA insidansını azaltmıştır (65). Kullanıma hazır Epoetin alfa enjektörlerinde, formülasyon yardımcı maddesi olarak insan serum albümini yerine polisorbat 80 kullanılmaya başlandığında eritropoetin- antikor pozitif saf kırmızı hücre aplazisi (PRCA) olgularında artış gözlenmiştir (66).
Saklama ve Stabilite
Biyoteknolojik ilaçların raf ömrünü belirleyebilmek için üretim sürecinde etkin madde ve bitmiş ürün üzerinde, primer ambalaj materyali içinde gerçek zamanlı, hızlandırılmış ve stres stabilite testleri yapılır. Stabilite testleri kapsamında potens, saflık, fiziksel görünüm, pH, liyofilize ürünlerde nem içeriği ve sterilite değerlendirilir, moleküler karakterizasyon yapılır. İlacın primer ambalaj materyali ve kap kapak sistemiyle etkileşimi değerlendirilir. Primer ambalaj materyalinden gelebilecek ekstrakte edilebilir (tüketilebilir) ve sızabilir maddelerin tayini yapılır (67).
Biyoteknolojik ilaçların stabilitelerini koruyabilmeleri için 5±3 °C’de saklanması ve soğuk zincirle transfer edilmesi gereklidir. Sıcaklık, pH, eksipiyanlar, karıştırma / çalkalama, hava ve ışıkla temas, nem, kap kapak sistemi, saklama koşulları protein yapısındaki ürünün stabilitesini değiştiren faktörlerdir (59,64,68). Bu faktörler ürünün biyoaktivitesini ve immünojenisitesini etkilemektedir (68-71).
İlacın infüzyon setleriyle geçimsizliği değerlendirilmelidir. Biyoteknolojik ilaçlar hastaya seyreltilerek uygulanacak ise Kısa Ürün Bilgisinde (KÜB) belirtilen geçimsizlik bilgileri dikkate alınmalı; ilaçla geçimli olmayan seyreltici, infüzyon torbası ve seti kullanılmamalı ve kesinlikle çalkalanmamalıdır. Farklı üreticiler tarafından üretilmiş biyolojik ürünler birbiriyle karıştırılmamalıdır. Hasta kullanımı sırasında meydana gelebilecek yanlış taşıma ve saklama gibi ürünün stabilitesini etkileyebilecek stres koşulları ürünün biyolojik aktivitesini ve immünojenisitesini değiştirebilir. Stabilitesini kaybeden ilacın görünüşünde değişiklikler, biyoaktivite kaybı, biyoyararlanımında farklılıklar nedeniyle hastada immün reaksiyonlar ve advers etkiler görülebilir (71,72). Eğer ilacın fiziksel özelliklerinde gözle görülür bir değişiklik olursa (renginde değişme, bulanıklık, agregasyon, vb.) veya soğuk zincir bozulursa (ortam sıcaklığının 5±3 °C’nin üzerine çıktığı durumlar) ilaçlar kullanılmamalıdır.
Üretim, taşıma, saklama ve hasta kullanımı sırasında meydana gelebilecek ve ürünün stabilitesini etkileyebilecek stres koşulları Tablo 5’te verilmiştir (58).
Tablo 5. Üretim, taşıma, saklama ve hasta kullanımı sırasında meydana gelebilecek stres koşulları

Biyoteknolojik ilaçlar peptit / protein yapısında ürünlerdir. Proteinler polipeptidin amino asit dizisine bağlı olarak; çoklu, zayıf kovalent olmayan etkileşimlerle büyük oranda stabilize olmuş, üç boyutlu konformasyona sahiptir. Işık, oksidasyon, iyonik bileşenler, sıcaklık değişimi, mekanik karıştırma gibi zayıf kovalent olmayan etkileşimleri bozan herhangi bir etki polipeptidin doğal konformasyonunun bozulmasına neden olur. Meydana gelen denatürasyon fonksiyonel aktivitenin kaybına neden olur (60).
Biyofarmasötiklerin fiziksel ve kimyasal stabilite problemleri Tablo 6’da görülmektedir.
Tablo 6. Biyofarmasötiklerin fiziksel ve kimyasal stabilite problemleri

Biyofarmasötiklerin stabilitesini sağlayabilmek için liyofilizasyon, formülasyona spesifik eksipiyanların eklenmesi, uygulama yoluna spesifik çözümler, taşıyıcı sistemlerin geliştirilmesi ve taşıyıcı sistemlerin modifikasyonu gibi formülasyon stratejilerinde değişiklikler yapılabilir.
Fiziksel stabilitenin artırılması için formülasyon geliştirme sırasında farklı eksipiyan kullanımı gereklidir. Formülasyon bileşimindeki tuzlar proteinlere bağlanarak denatürasyon ve agregasyonu azaltır. Polialkoller, seçici çözünmeyle ürünü stabilize eder. Sürfaktanlar, proteinlerin ara yüzeylere adsorbsiyonunu engeller. Kimyasal stabilitenin artırılması için uygun ortam koşullarının sağlanması (pH, iyonik güç, sıcaklık, prezervatif kullanımı), yönlendirilmiş mutagenez (kimyasal olarak reaktif amino asitlerin reaktif olmayan amino asitlerle yer değiştirildiği işlem) ve proteinlerin kimyasal modifikasyonu (PEGilasyon) gereklidir (57,73).
Biyofarmasötikler genellikle paranteral (i.v., i.m., s.c.) uygulanmasına karşın; pulmoner, oküler, oral, nazal, transdermal, transmukozal yollarla da uygulanabilir. Formülasyonları uygulama yoluna özel olarak hazırlanmalıdır.
Biyoteknolojik ilaçlar peptit / protein yapısında olup, küçük kimyasal moleküllerden üretim yöntemi, boyut, stabilite ve immünojenisite açısından farklılıklar gösterir. Rekombinant protein üretimi sırasında üretimde kullanılan ekspresyon vektörleri, hücre hattı, üretim koşulları (sıcaklık, büyüme oranı, besi yeri bileşenleri, ortam pH’ı) ve saflaştırma işlemi gibi üretim sürecine ait üst akım ve alt akım işlemlerindeki parametreler proteinin konformasyonel yapısını, post translasyonel modifikasyonlarını, safsızlık seviyesini ve çözünürlüğünü değiştirir. Kültür ortamı ve hücre büyümesi şartları proteinin glikozilasyonunu, glikozilasyon derecesi de proteinin etkililiğini ve güvenliliğini değiştirmektedir. Ürün ya da üretim işlemi kaynaklı safsızlıklar ve post
translasyonel modifikasyonlar ürünün immünokimyasal özelliğini etkiler. Saflaştırılan rekombinant proteinin ilaç olarak kullanılabilmesi için, stabilitesini sağlayacak şekilde formülasyonunun hazırlanması ve gerekli dozda borosilikat Tip 1 cam flakon veya kullanıma hazır enjektör içerisinde ambalajlanması gereklidir. Ürünün saklama sıcaklığı, saklama sırasında primer ambalaj materyali ile etkileşimi ve kap kapak sisteminden gelen ekstrakte edilebilen (tüketilebilir) ve sızabilen maddelerin ortamdaki varlığı, ürünün biyoaktivitesini ve immünojenisitesini etkilemektedir.
Biyoteknolojik ilaçlarda üretim süreci ürünün kendisidir ve üretim sürecindeki değişkenler elde edilen ürünün kalitesini, güvenliliğini ve etkililiğini belirlemektedir. Üretim sürecinin herhangi bir aşamasında meydana gelebilecek değişiklikler üründe farklılıklara neden olur. Bu farklılıkların ürünün güvenlilik ve etkililiğini değiştirmediği preklinik ve klinik çalışmalarla gösterilmelidir.
KAYNAKLAR