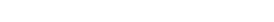İÇİNDEKİLER
- Önsöz
- Giriş
- Biyoteknolojik İlaçlar ve Üretim Süreçleri
- Biyobenzer İlaçlar ve Karşılaştırılabilirlik
- Biyobenzer Ürünlerde Ekstrapolasyon
- Biyobenzer İlaçlarda Değiştirilebilirlik
- Biyoüstünler
- Referans Ürünle Yeterli Karşılaştırma Çalışması Olmayan Biyolojik Ürünler
- Biyolojik ve Biyobenzer İlaçlarda Farmakovijilans, İzlenebilirlik ve Risk Yönetimi
- Yazarlar
BİYOBENZER İLAÇLAR VE KARŞILAŞTIRILABİLİRLİK
Biyoteknolojik ilaçların patent sürelerinin dolmaya başlamasıyla birlikte ilaç endüstrisinde orijinal biyolojik / biyoteknolojik ilaçların biyobenzerleri de geliştirilmeye başlanmıştır. Biyoteknolojik ilaçlar kimyasal ilaçlardan farklı olarak kendilerine özgü üretim teknolojileri ile üretilir. Bu nedenle biyobenzer ilaçların geliştirilmesi ve biyobenzerliğin gösterilmesi; kimyasal beşeri tıbbi ürünler için biyoyararlanım ve biyoeşdeğerlik çalışmalarını kapsayan standart jenerik ilaç yaklaşımından farklılık göstermektedir.
Biyobenzer ilaçlar, ulusal ve uluslararası yasal otoritelerin de belirttiği gibi, referans tıbbi ürün ile karşılaştırılabilir özellikte olmalı ve kapsamlı karşılaştırılabilirlik çalışmaları ile referans tıbbi ürüne yüksek oranda benzerliği gösterilmelidir.
FDA biyobenzer ilacı ‘FDA tarafından ruhsatlandırılmış bir referans ürünle yüksek oranda benzerlik gösteren ve klinik olarak anlamlı bir farkı olmayan biyolojik ürün’ olarak tanımlamıştır. Biyobenzer geliştiren bir üretici, hem referans tıbbi ürünün hem de önerilen biyobenzer tıbbi ürünün yapısını ve fonksiyonunu kapsamlı bir şekilde analiz ederek ürününün referans tıbbi ürüne yüksek oranda benzerliğini gösterir. Saflık, kimyasal kimlik ve biyoaktivite gibi ürünlerin özelliklerini karşılaştırmak için en son teknoloji kullanılmaktadır. Üretici, biyobenzer tıbbi ürünün referans tıbbi ürüne yüksek oranda benzerliğini göstermek için bu karşılaştırmalı testlerin sonuçlarını diğer bilgilerle birlikte kullanır (1).
EMA biyobenzer ilacı ‘Avrupa Birliği’nde ruhsatlandırılmış olan bir biyolojik ilaca (referans ilaç) yüksek oranda benzerlik gösteren biyolojik ilaç’ olarak tanımlamıştır. Biyobenzerler, tüm biyolojik ilaçlar için geçerli olan farmasötik kalite, etkililik ve güvenlilik standartlarına göre onaylanmaktadır. Biyobenzer geliştirilmesindeki amaç yapı, biyolojik aktivite, etkililik, güvenlilik ve immünojenisite profili açısından yüksek oranda benzerliğin gösterilmesidir (2-4).
T.C. Sağlık Bakanlığı Türkiye İlaç ve Tıbbi Cihaz Kurumu tarafından çıkarılan ‘Biyobenzer Tıbbi Ürünler Hakkında Kılavuz Taslağı’nda biyobenzer tıbbi ürün ‘Ruhsatlı bir biyolojik referans tıbbi ürüne yüksek düzeyde benzerlik gösteren ürün’ olarak tanımlanmıştır (5). Kapsamlı bir karşılaştırılabilirlik çalışmasına dayalı olarak, kalite, güvenlilik ve etkililik bakımından referans tıbbi ürüne benzerliğin gösterilmesi gerekmektedir.
Biyobenzer ilaçların fiziksel, kimyasal ve biyolojik özellikleri referans ilaca yüksek düzeyde benzer olmalıdır. Biyobenzer ilaçlar referans ilaçlarla aynı gen dizisine sahiptir ve benzer teknolojiyle üretilir. Ancak klonlama vektörü, konakçı hücre, fermantasyon koşulları, saflaştırma işlemleri ve formülasyon farklılıkları nedeniyle üretim süreci sonunda farklı biyofiziksel özelliklere sahip biyobenzer ürün elde edilir (6,7). Biyobenzer ilaçlar, ileri teknolojik yöntemler kullanılarak ürünün farmasötik gelişimine uygun şekilde üretilmelidir. Bir biyobenzer ilacın etkin maddesi, moleküler ve biyolojik bakımdan referans ilacın etkin maddesine yüksek düzeyde benzer; pozolojisi ve uygulama yolu, referans ilacın pozolojisi ve uygulama yolu ile aynı olmalıdır (5-8). Biyobenzer ilacın; farmasötik formu, yitiliği, formülasyonu ve yardımcı maddeleri referans ilaçtan farklı olduğunda, güvenlilik riski yaratmadığından emin olunmalıdır (9-12).
Biyobenzer olarak geliştirilen ilacın referans ilaçla benzerliğinin gösterilmesi için karşılaştırılabilirlik çalışmalarının yapılması gereklidir (6).
Biyobenzerlik çalışmasında kullanılacak referans ilaç yetkili otoriteler tarafından tam dosyayla ruhsatlandırılmış ve satış onayı almış olmalıdır. Tüm kalite, güvenlilik ve etkililik çalışmalarının her biri için biyobenzer ilaç, aynı referans ilaçla karşılaştırılmalıdır.
Biyobenzer ilaçların geliştirilmesi süreci aşamalı bir yaklaşımla yapılmaktadır. Fizikokimyasal ve biyolojik karakterizasyon çalışmaları sonrası klinik dışı ve klinik çalışmalar ile karşılaştırılabilirlik gösterilmelidir. Yapılacak klinik dışı ve klinik in vivo çalışmaların kapsamı, fizikokimyasal, biyolojik ve klinik dışı in vitro verilerden elde edilen kanıtlara bağlıdır. Klinik çalışmaların amacı, biyobenzer ilacın ve referans ilacın klinik etkililik ve güvenlilik profillerinin karşılaştırılabilmesidir.

Şekil 1. Biyobenzer ilaçlarda karşılaştırılabilirliğin gösterilmesi için yapılması gereken çalışmalar
Karşılaştırılabilirlik çalışmalarında amaç; biyobenzer ilacın bütün özelliklerinin kalite, etkililik ve güvenlilik açısından referans ilaca benzerliğini ortaya koymaktır. Etkin madde ve bitmiş ürün kapsamında karşılaştırma çalışmaları ve değerlendirme yapılır.
Karşılaştırılabilirlik çalışmaları üç ana çerçevede yapılmalıdır (6).
• Kalite karşılaştırılabilirliği
• Preklinik karşılaştırılabilirlik
• Klinik karşılaştırılabilirlik
Biyobenzer ilacın referans ilaç ile karşılaştırılabilirliği bilimsel kanıtların toplamı ile değerlendirilir.
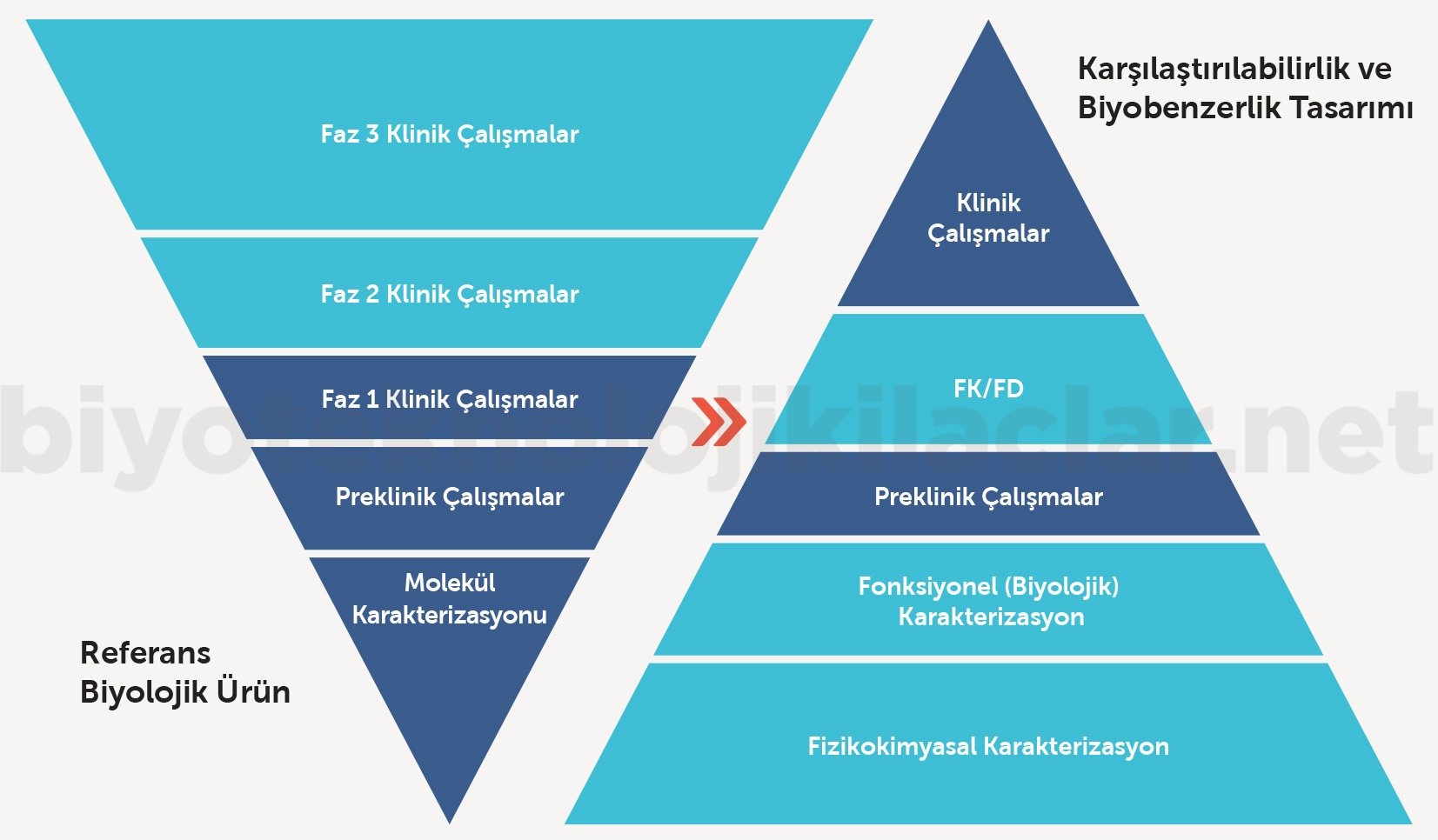
Şekil 2: Biyobenzerlerin karakterizasyonu için bilimsel kanıt bütünlüğü piramidi
Karşılaştırılabilirlik çalışmasında kalite karşılaştırması esastır. Kalite benzerliğini göstermek için valide edilmiş yüksek duyarlılıkta güncel analitik teknikler kullanılarak, etkin madde ve bitmiş ürün kapsamında referans ilaçla başa baş karşılaştırma çalışmalarının yapılması gereklidir. Biyobenzer ve referans ilaç arasındaki farklılıkların güvenlilik ve etkililik üzerine potansiyel etkisi değerlendirilmelidir. Kalite karşılaştırma verilerinin yeterliliğiyle preklinik ve klinik karşılaştırılabilirlik çalışmalarının kapsamına karar verilir.
Biyobenzer ilaçlarda karşılaştırılabilirlik çalışmaları iki temel nedenle yapılmaktadır.
• Biyobenzer ilaçlarda referans ilaçla biyobenzer ilaç arasında kalite, güvenlilik ve etkililik açısından anlamlı farklılıkların olmadığının gösterilmesi (5,6,8,13)
• Aynı ürün için üretim sürecinde yapılan değişiklikler sonrası seriler arası benzerliğin gösterilmesi (14)
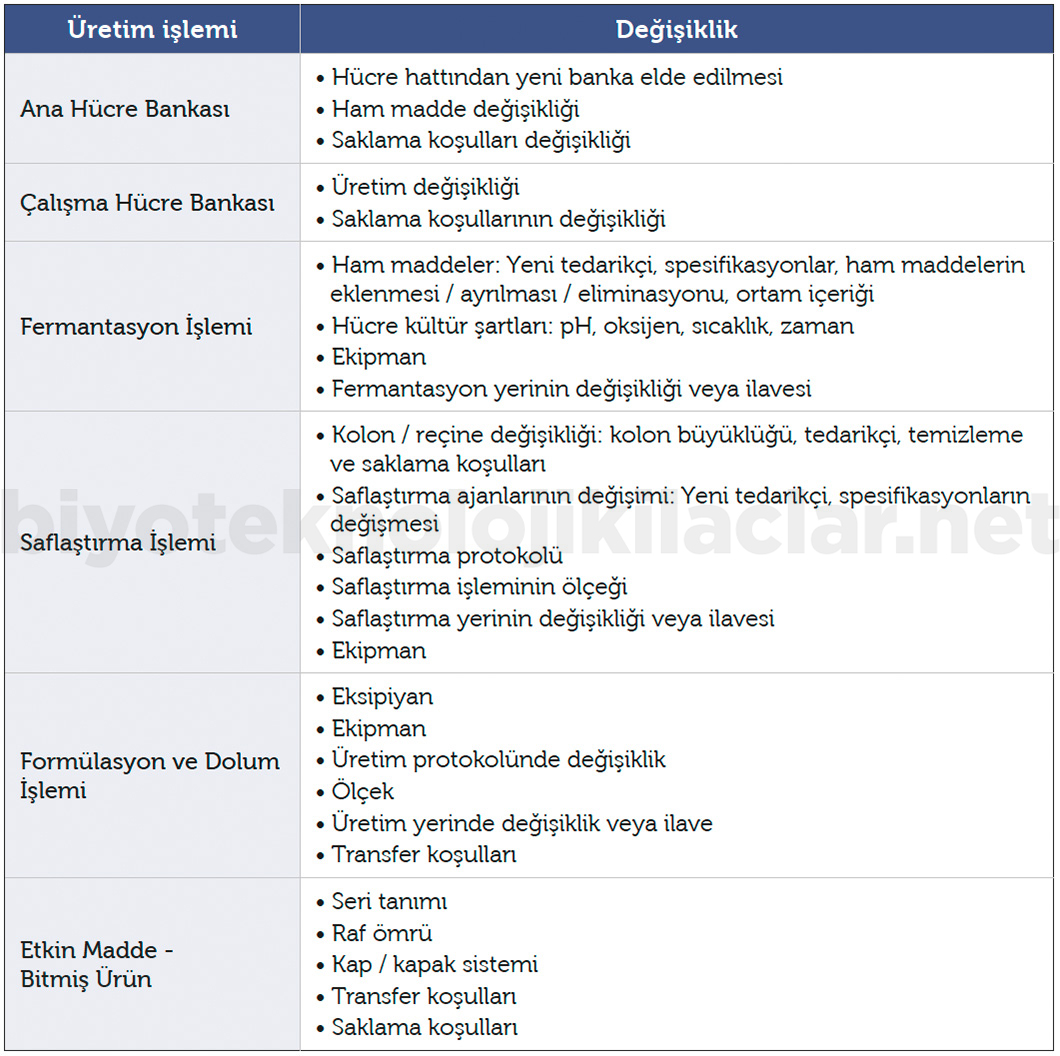
Üretim sürecinde üretim işlemlerinde yapılabilecek değişiklikler aşağıdaki gibidir.
- Ana hücre bankası ve çalışma hücre bankası üzerinde yapılan değişiklikler
- Fermantasyon işleminde yapılan değişiklikler
- Saflaştırma işleminde yapılan değişiklikler
- Formülasyon ve dolum işlemi sırasında yapılan değişiklikler
- Etkin madde ve bitmiş üründe yapılan değişiklikler
Üretim işlemlerinde yapılabilecek değişiklikler Tablo 1’de görülmektedir.
Bu değişikliklerden sonra karşılaştırılabilirlik çalışmalarının yapılması gereklidir (7,14).
Tablo 1. Üretim işlemlerinde yapılabilecek değişiklikler
Üretim sürecinde yapılan değişikliklerin ürünün kalite, güvenlilik ve etkililiğini değiştirmediğini göstermek için aşağıdaki veriler değerlendirilmelidir (14).
- Kalite özelliklerini gösteren ilgili fizikokimyasal ve biyolojik karakterizasyon verileri
- Üretim sürecinin uygun aşamalarından elde edilen ilgili örneklemlerin analizinden çıkan sonuçlar (örneğin ara ürün, etkin madde ve müstahzar)
- Ürünün bozunma profilini ve ürünle ilgili safsızlıklardaki potansiyel farklılıkları göstermek amacıyla yapılan hızlandırılmış ve/veya stres stabilite çalışmaları verileri
- Üretim tutarlılığının gösterilmesi için kullanılan serilere ait veriler
KAYNAKLARBiyobenzer ilaçlarda üretim süreci ürünün kendisini oluşturmaktadır. Üretim sürecinde üst akım ve alt akım işlemlerine ait faktörler, üretim süreci sonunda biyobenzer proteinin fizikokimyasal özelliklerini, biyoaktivitesini ve immünojenisitesini değiştirebileceğinden; üretim sürecinde yapılan değişiklikler biyobenzer ilacın etkililiğini ve güvenliliğini değiştirebilir. Bu nedenle biyobenzer ilaçların referans ilaca benzerliğinin gösterilebilmesi için karşılaştırmalı kalite, preklinik ve klinik çalışmaların yapılması gerekmektedir.
Biyobenzer ilaca ait spesifik kalite özellikleri ile güvenlilik ve etkililik arasında ilişki kurulamadığı durumlarda ve üretim sürecinde yapılan değişiklik öncesinde ve sonrasında ürünün kalite özellikleri arasında farklılıklar gözlemlendiğinde, karşılaştırılabilirlik çalışmasına kalite, preklinik ve/veya klinik çalışmaların dahil edilmesi gereklidir (14).