İÇİNDEKİLER
- Önsöz
- Giriş
- Biyoteknolojik İlaçlar ve Üretim Süreçleri
- Biyobenzer İlaçlar ve Karşılaştırılabilirlik
- Biyobenzer Ürünlerde Ekstrapolasyon
- Biyobenzer İlaçlarda Değiştirilebilirlik
- Biyoüstünler
- Referans Ürünle Yeterli Karşılaştırma Çalışması Olmayan Biyolojik Ürünler
- Biyolojik ve Biyobenzer İlaçlarda Farmakovijilans, İzlenebilirlik ve Risk Yönetimi
- Yazarlar
REFERANS ÜRÜNLE YETERLİ KARŞILAŞTIRMA ÇALIŞMASI OLMAYAN BİYOLOJİK ÜRÜNLER
Non-comparable Biological Products (NCB)
Prof. Dr. İrfan Çiçin
NCB, mevcut ruhsatlı bir referans biyolojik ürünle doğrudan karşılaştırılmamış ve/veya karşılaştırmalı analizleri eksik yapılmış biyolojik ürünlerdir.
NCB’ler Dünya Sağlık Örgütü (WHO) “Benzer Biyoterapötik Ürünler Kılavuzuna” göre uygun ruhsat gereksinimlerini sağlayamayan; kalite, güvenlilik ve etkililik çalışmaları kılavuzlara yeterince uygun yapılmamış ürünlerdir (intended copy). Bu terim ilk defa IFPMA (International Federation of Pharmaceutical Manufacturers & Associations) tarafından kullanılmıştır. Biyobenzer adı altında pazar erişimi sağlanmaya çalışılsa da biyobenzerlerin kabul edilmiş kriterlerini yeterince karşılamamaktadır (Şekil 1).
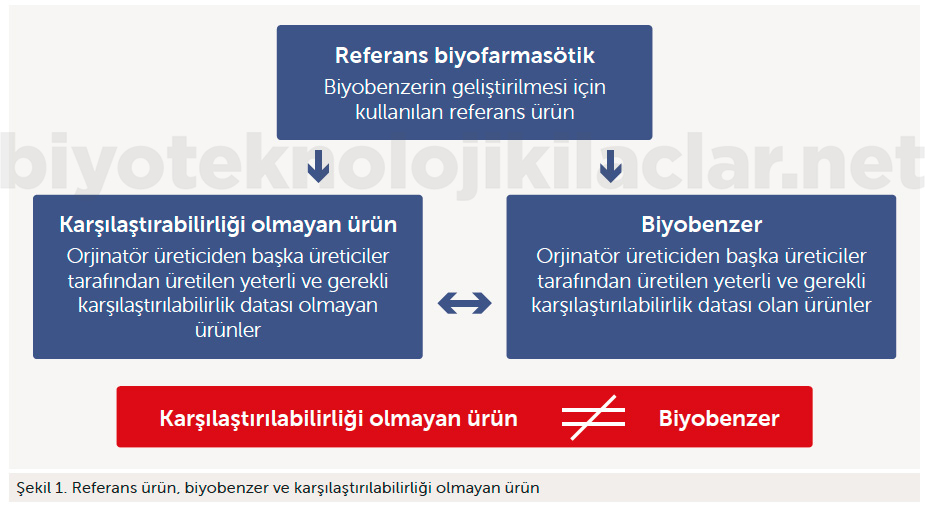
Avrupa İlaç Ajansı (EMA) ile WHO’nun biyobenzer kavramına bakışı benzerlik göstermektedir. Daha önce onaylanmış orijinal biyolojik ilacın (referans ilaç) aktif maddesini içeren benzer versiyon ürün kalite özellikleri, biyolojik aktivite ve güvenlilik açısından benzerlik göstermelidir. Bunun içinde kapsamlı bir karşılaştırılabilirlik çalışması şarttır.
NCB’ler birçok ülkede ruhsat alsa bile etkililik, güvenlilik, kalite açısından çalışmaları yeterli olmadığı için ciddi gelişmiş regülasyon sistemi olan ülkelerde izin alamaz. NCB’ler değişik ülkelerde ülke sağlık otoritelerinin düzenlemelerine bağlı olarak değişik yöntemlerle kullanıma girebilmektedir (Şekil 2).

Bir biyobenzer üretmek kimyasal ilaçlardan farklı olarak, karmaşık moleküler yapı olması nedeniyle çok daha zordur. Biyobenzer ilaçların orijinal biyolojik ilacın birebir aynısı olması imkansızdır. Özellikle romatoloji ve onkoloji alanlarında geliştirilen biyobenzerlerin kalite, güvenlilik ve etkililik açısından orijinal biyolojik ürünle ayrıntılı karşılaştırmalı çalışmalarının olması gerektiği vurgulanmaktadır. NCB’lerin çoğunda bu karşılaştırmalı çalışmalar uluslararası regülasyon kurallarına, örneğin WHO kılavuzuna göre yapılmamıştır, eksiktir. Bazen de başka bir biyobenzerin çalışmaları kullanılarak, başvuru ürünü için çalışma yapılmaksızın ruhsat dosyası hazırlanır. Bir başka biyobenzerin güvenlilik ve etkililik profiline atıfta bulunarak onay istemek sorgulanmalıdır. Yeterince karşılaştırılabilirlik verisi olmayan ürünlerin etkililik ve güvenlilik sorunları öngörülemez (Şekil 3).

Bu ürünler için iki önemli aşama söz konusudur:
1. Kalite
Tüm biyoterapötik ilaçlar orijinal veya biyobenzer olsun üretim aşamasında sabit, iyi karakterize edilmiş bir hücre dizisine sahip olmalı, valide edilmiş bir üretim metodu ve kontrol mekanizması kurulmalıdır (“CMC”; Kimya, Üretim ve Kontroller). Ruhsat dosyasında bunlar açık olarak anlatılır. NCB’lerin çoğunda bu veriler ya eksiktir ya da başka üründen alınmıştır.
2. Klinik Güvenlilik ve Etkililik
Biyobenzerler için en büyük sorun kimyasal ilaçta olduğu gibi, jenerik ilaç yaklaşımıyla düşünülerek bazı klinik çalışmaların yapılmamasıdır. En önemlisi immünojenisite verilerinin öncelikle eksik kalmasıdır. NCB’lerde klinik çalışmalar kısa, yetersiz veya başka bir biyobenzere atıf şeklindedir. Öncelikle farmakokinetik (FK) ve farmakodinamik (FD) fark olabilir. NCB pozolojisi değişebilir. Ciddi farmakovijilans sistemlerinin yokluğunda bu sorun çok geç anlaşılabilir. Dolayısıyla etki kaybı ya da yan etki artışı durumlarında başarısızlıkların telafi edilebilmesi önemli sorundur.
Dünyada NCB’ler
Dünyada birçok ülke biyolojik ilaçlar için ulusal regülasyon şartlarını oluşturmaktadır. NCB’ler bazı ülkelerde lisans almıştır. Bu ülkelerde kimyasal jenerik ilaç gibi düşünülmüş veya az veriyle yetinilmiştir. Bu ülkelerin çoğunda regülasyon kuralları yerleşmemiş veya eksiktir. 2009 WHO kılavuzu dahi yol gösterici olmamıştır. Zaman içinde kalite farklılıkları ve benzerlik eksikliği gösteren çok sayıda yayın çıkmaya başlamıştır. Sağlıklı farmakovijilans verileri için orijinal biyolojik, biyobenzer ve NCB’lere kodlandırma sistemi getirilme gereksinimi günümüzde tartışılmaktadır.
NCB’ler hastalar için düşük tedavi sonuçları verebilir. Azalmış cevap, cevapsızlık, advers etki, toksisite reaksiyonu ve hatta ölüm vakaları olabilir. Bu ürünler sağlık sistemleri içinde yüksek maliyetli komplikasyonlara neden olabilir. Genel yaklaşım NCB’lerin WHO kılavuzuna göre eksikliklerini tamamlayarak gerçek biyobenzer niteliğini almasıdır. Bu süreçte aslında zordur ve bazı faktörler ilaç otoritesi açısından önemlidir:
1. Ürünün kullanım derecesi (örneğin, etkilenen hasta sayısı)
2. Piyasada uygun şekilde lisanslanmış gerçek biyobenzer ve orijinalin varlığı
3. Hasta popülasyonunun demografisi (çocuk veya yetişkin)
4. Ülkedeki farmakovijilans sisteminin gücü
5. Kesintisiz tedavi için ürünün piyasada olması ihtiyacı
WHO kılavuzu doğrultusunda gereklilikler yerine getirilmelidir.
NCB’lerin varlığında en önemli görev farmakovijilans sistemine düşmektedir. Farmakovijilans ile ilgili detaylı bilgi Bölüm VIII’de verilmektedir.
KAYNAKLARKarşılaştırılabilirliği olmayan biyolojik kopya ürünlerin biyobenzer olarak tanımlanmaması, bu konuda hekim ve sağlık otoritelerin daha dikkatli olması gerekir.