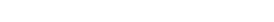İÇİNDEKİLER
- Önsöz
- Giriş
- Biyoteknolojik İlaçlar ve Üretim Süreçleri
- Biyobenzer İlaçlar ve Karşılaştırılabilirlik
- Biyobenzer Ürünlerde Ekstrapolasyon
- Biyobenzer İlaçlarda Değiştirilebilirlik
- Biyoüstünler
- Referans Ürünle Yeterli Karşılaştırma Çalışması Olmayan Biyolojik Ürünler
- Biyolojik ve Biyobenzer İlaçlarda Farmakovijilans, İzlenebilirlik ve Risk Yönetimi
- Yazarlar
BİYOBENZER İLAÇLARDA KLİNİK ÇALIŞMALAR VE KARŞILAŞTIRILABİLİRLİK
Değiştirilebilirlik (interchangeability), en yalın anlamıyla, aynı klinik etkiye sahip iki veya daha fazla ilacın aynı hastalığı tedavi etmek amacıyla birbirinin yerine kullanılabilme durumunu anlatan bir terimdir (1).
Kimyasal sentez yoluyla elde edilen ve çoğunlukla basit inorganik moleküler yapıda az sayıda atomun bir araya gelmesiyle oluşan kimyasal ilaçların piyasaya ilk sürülenleriyle (referans ilaç) patent süresinin dolması sonrası üretilmeye başlanan jenerik ilaçlar birbirlerine tıpatıp benzemeleri nedeniyle doğrudan “değiştirilebilir”, bir başka deyişle “birbirinin yerine kullanılabilir” kabul edilmektedir (2). Ancak moleküler boyutları ve yapıları kimyasal ilaçlarla karşılaştırılamayacak kadar büyük ve karmaşık olan, canlı hücresel ortamlarda biyolojik sentez yoluyla üretilen (çoğunlukla) protein temelli biyolojik / biyoteknolojik ilaçlarla bunların benzerlerinin (biyobenzer ilaçlar) birbirine tıpatıp benzeme olasılığı yoktur;
Dolayısıyla orijinal biyolojik ilaçlarla biyobenzerlerinin yeterli bilimsel kanıt olmadan, doğrudan değiştirilebilir kabul edilmesi ve tedavi esnasında birinden diğerine geçilmesi uygun bulunmamaktadır (2).
Değiştirilebilirlik kavramının daha iyi anlaşılması ve öneminin ortaya konulabilmesi kimyasal ve biyolojik ilaçların yapılarındaki ve dolayısıyla ruhsatlandırma süreçlerindeki farklılıkların bilinmesiyle mümkündür. Salisilik asit etken maddeli Aspirin® kimyasal ilaçlara iyi bir örnektir. Aspirin® (C9 H8 O4) yaklaşık 180 Daltonluk moleküler ağırlığa sahip 21 atomdan oluşan inorganik bir kimyasal bileşiktir. Kimyasal sentez yoluyla basitçe üretilebilir. Bugün dünyada birçok ruhsatlı Aspirin® jeneriği mevcuttur.
Tanım gereği “jenerik ilaçlar”; referans ilaçla aynı etkin maddeleri içeren, aynı deneysel koşullarda ve aynı molar dozda uygulandığında biyoyararlanımları önceden saptanmış sınırlar içinde farklılık göstermeyen farmasötik eşdeğer veya farmasötik alternatif ürünlerdir (3,4). Jenerik ürünün aynı endikasyonlarda ruhsat alabilmesi, yani tedavi amaçlı orijinal ürün (Örn: Aspirin®) yerine kullanılabilmesi için “ eşdeğerlilik çalışmaları” ile kimyasal, farmasötik ve biyoeşdeğerlilik açıdan karşılaştırılması ve orijinal üründen belirgin bir farkının olmadığının kanıtlanması yeterlidir.
Kimyasal eşdeğerlik ile kastedilen jenerik ürün ile referans ilaç içindeki etkin maddelerin kimyasal yapılarının aynı olduğunun gösterilmesidir. Farmasötik eşdeğerlilik ise kimyasal eşdeğer olduğu gösterilmiş iki ilacın (referans ilaç ve jenerik) etkin madde miktarı ve dozaj şekillerinin (tablet, ampul vb.) aynı olmasıdır. Bu iki aşamadan sonra farmasötik eşdeğer iki ilacın biyoeşdeğerliği in vitro (disolüsyon) ve in vivo (biyoeşdeğerlik) deneylerle yapılan karşılaştırmayla gösterilir. Jenerik ürünle yukarıda belirtilen eşdeğerlik çalışmalarının dışında ayrıca referans ilacın ruhsatlandırılması öncesinde yapılması zorunlu preklinik ve klinik faz çalışmalarının yürütülmesi çoğunlukla gerekmez. Dolayısıyla, basit moleküler yapıya sahip orijinal kimyasal ilaçların (Örn: Aspirin®) birebir eşdeğeri olan jenerik ürünler orijinal referans ilaçla aynı etkililik ve güvenlilik profiline sahiptir ve doğrudan “değiştirilebilir” olarak kabul edilir (3).
Biyolojik ilaçların moleküler yapısı kimyasal ilaçlardan çok daha karmaşıktır. Örneğin bir yüzey antijeni olan CD20’ye karşı geliştirilmiş bir monoklonal antikor olan rituksimab 150000 Daltondan fazla bir moleküler ağırlığa sahiptir ve 20009 atomdan oluşur (H9874N1688O1987S44). Biyolojik ilaçlar kimyasal sentez yoluyla değil, canlı sistemlerde (hücre kültür tankları) genetik kod karşılığı biyolojik sentez yoluyla üretilir. Çoğunlukla protein temelli olmak üzere organik yapıdadır. Moleküler yapıları sadece amino asitlerin yan yana dizilimiyle oluşan zincirlerden ibaret değildir. Bu zincirlerin farklı açı ve şekillerde katlanması ya da kıvrılması sonucu oluşmuş 3 boyutlu konfigürasyonlara sahiptir. Dolayısıyla canlı ortamlarda (hücre kültür tankları) üretilen, binlerce atomdan oluşan karmaşık 3 boyutlu bir yapıya sahip bu biyolojik ilaçların “kimyasal ilaç – jenerik” örneğinde olduğu gibi birebir aynı olması mümkün değildir. Biyolojik ilaçların kopyaları referans ilaçla tıpatıp aynı olamaz, en fazla benzeyebilir. Zaten bu nedenle, söz konusu ilaçlar “jenerik” değil “biyobenzer” olarak adlandırılmıştır. Dünyada bu konuda çıkarılmış yönetmeliklerde biyobenzer ilaç tanımı genellikle, ‘etken maddesi ruhsatlı biyoteknolojik veya biyolojik referans ilaca yüksek düzeyde benzerlik gösteren, onunla benzer güç ve kalitede olan ve aynı hastalığı tedavi etmek için kullanılan biyolojik ürün’ olarak yer almaktadır. Biyobenzerler adı üstünde en fazla “benzer” olabileceği için jenerik ilaçlarda olduğu gibi fizikokimyasal, farmasötik ve biyoeşdeğerlilik özelliklerinin karşılaştırılması biyolojik ilaçların benzerlerinin ruhsatlandırılmasında yeterli görülmemekte, klinik çalışmalarla ispatlanması gerekmektedir.
Biyobenzerlerin dizilim ve moleküler yapı bakımından orijinal biyolojik ilaca büyük oranda benzediğinin gösterilmiş olması, klinik olarak o ilacın, örneğin monoklonal antikorun, orijinal kadar etkili hedefe bağlanacağını veya bağlandıktan sonra aynı düzeyde biyolojik etki göstereceğini ifade etmez. Şeklen referans ilaçla biyobenzer birbirinden farksız görünse dahi reseptör veya antijene bağlanan bölgelerindeki ufak değişiklikler veya açısal farklılılar ilacın afinitesini dolayısıyla etkililiğini değiştirebilir (5).
Bir diğer önemli konu da güvenliliktir. Özellikle biyobenzer ürünlerde en temel sorunlardan biri, bir güvenlilik sorunu olan immünojenisitedir. Daha çok protein yapısında olan biyolojik ilaçlara karşı hastada antikor gelişimi gözlenebilir. Söz konusu antikorlar, ilaç üzerinde bağlandıkları bölgeye göre ilacın etkililiğini arttırabilir veya özellikle “nötralizan” karakterde olduklarında etkililiği azaltabilirler. Ayrıca hastada alerji vb. hipersensitivite reaksiyonları gibi aşırı immün yanıtlara yol açmak suretiyle ölümcül komplikasyonlara neden olabilirler (6).
Özetle, biyolojik ilaçların karmaşık büyük moleküler yapıda olması ve üretimlerinin doğrudan kimyasal sentezle değil, dolaylı olarak canlı sistemlerde yapılması nedeniyle birebir aynısı elde edilemez. Üretilen benzerlerinin orijinal biyolojik ürünle aynı endikasyonda ruhsatlanabilmesi ancak yapılan ek klinik çalışmalarla biyobenzer ilacın orijinal biyolojik ürünle kalite, etkililik ve güvenlilik açısından kabul edilebilir sapma düzeyi içinde benzerlik göstermesiyle mümkün olabilir.
Yukarıda ayrıntılı şekilde anlatılan gerekçeler doğrultusunda “değiştirilebilirlik” jenerik ilaçlarda doğal bir özellik olarak kabul edilirken biyobenzer ilaçlarda düzenleme gerektiren bir konudur. Değiştirilebilir kabul edilen bir biyobenzerin kullanımında değiştirme yetkisinin kimde olacağı konusu da tartışmaya açıktır. Dünyada bu noktada bir uzlaşı yoktur. Kimi ülkelerde biyobenzer ilacın ruhsat almış olması ilgili endikasyonda doğrudan “değiştirilebilir” olarak kabul edilmesine izin vermektedir. Bazı ülkelerde orijinal ilacın biyobenzerleriyle değiştirilmesi kararı hekime bırakılırken (“medical switching”); diğerlerinde sağlık otoritesi değiştirilebilir olarak kabul ettiği ilaçların hekimin insiyatifi dışında eczacı tarafından değiştirilmesine izin vermektedir.
Değiştirilebilir kabul edilen ürünlerin hekim inisiyatifinde değiştirilmesi özellikle güvenlilik endişelerinin yüksek olduğu biyolojik ilaçlar için hayati önem taşımaktadır.
Hekimin reçetelediği ilacın kullanılıp kullanılmadığını bilmemesi ve takip edememesi farmakovijilans ve izlenebilirlik açısından büyük bir sorun oluşturmaktadır. Bu bağlamda tartışılması gereken bir başka konu da birden fazla biyobenzeri bulunan ürünlerde birden fazla ürünün ardışık kullanılmasıyla oluşan izlenebilirlik zafiyetidir. Örnek verilecek olursa, miyelodisplatik sendrom hastalığı olan ve anemisinin tedavisinde eritropoietin kullanan bir hastaya piyasada bulunan 4 biyobenzer ilaç tedavi boyunca değiştirilerek reçete edilmişse meydana gelebilecek bir advers etkinin hangi biyobenzere ait olduğunu ortaya çıkarmak son derece güç olabilir. Literatürde eritropoietin kullanımıyla aylarca sonra hastalarda ortaya çıktığı bildirilen “saf eritroid dizi aplazisi” bir tür gecikmiş immünojenisite örneğidir ve tedavide orijinal ürün yanında biyobenzerlerinin de değiştirilerek kullanılmış olması durumunda hangi ilaca bağlı geliştiğinin tespiti mümkün olmayabilir (7). O nedenle, değiştirilebilir kategorisinde bulunan biyolojik ürün ve biyobenzerlerinden hangisiyle tedaviye başlanmışsa onunla devam edilmesi, gerekmedikçe değiştirilmemesi etki ve yan etki izlemi (farmakovijilans) açısından son derece önemli kabul edilmektedir.
Orijinal biyolojik ilaçların biyobenzerleriyle veya biyobenzerlerin kendi aralarında değiştirilebilirliğiyle ilişkili bir diğer güvenlilik / izlenebilirlik sorunu da içerdikleri etken maddenin adlandırılması noktasındadır. Jenerik ilaçlar birebir aynı kabul edilmeleri nedeniyle kimyasal referans ilacın kısa ürün bilgisinde (KÜB) yer alan etken madde adı dahil tüm içeriği kullanma hakkına sahipken, biyolojik ürünlerle biyobenzerleri arasında böyle bir durum söz konusu olamaz. Biyobenzer ilaçlar referans ilaçla değiştirilebilir kabul edilmiş olsalar dahi içerdikleri etken madde birebir orijinalle aynı olmadığından mutlaka farklı bir INN’si (international non-proprietary name – uluslararası mülkiyete konu edilemeyen isim) bulunmalı ve bu sayede güvenlilik ve etkililik açısından orijinal molekülden farklı şekilde izlenebilir olmalıdır. Biyolojik ilaçlar ve biyobenzerlerin adlandırılmasıyla ilişkili olarak yine ülkeler arası değişik uygulamalar bulunmaktadır. Bu konuya ilerleyen bölümlerde ayrıntılı olarak değinileceğinden burada daha fazla tartışılmayacaktır.
Yine değiştirilebilirlik kavramıyla yakından ilişkili bir başka kavram da daha önceki bölümlerde ayrıntıları verilen “ekstrapolasyon” konusudur (8). Birden fazla endikasyonda ruhsatlı bir biyolojik ürün için geliştirilen biyobenzer hangi endikasyonda çalışmalarını tamamlamış ve ruhsatlandırılmış ise ancak o endikasyonda değiştirilebilir. Örneğin, B hücreli Hodgkin dışı lenfoma ve romatoid artrit endikasyonlarında ruhsatlı rituksimabın biyobenzeri sunduğu karşılaştırmalı çalışmalardan elde ettiği kanıtlar neticesinde sadece B hücreli Hodgkin dışı lenfomada kullanım ruhsatı almışsa yani eldeki tıbbi kanıtlar verilen ruhsatın romatoid artriti kapsayacak şekilde genişletilmesine (ekstrapolasyon) olanak sağlayacak düzeyde değilse değiştirilebilirlik de sadece B hücreli Hodgkin dışı lenfoma endikasyonuyla sınırlı kalmalıdır.
Yukarıda anlatılan hususlar temelinde değiştirilebilirlik kavramı özellikle patent süresi dolan biyolojik ilaçlara benzer olarak geliştirilen ilaçların ruhsatlandırılması aşamasında dikkate alınması gereken bir noktadır ve çok iyi denetlenmelidir. Değiştirilebilirlik tanımı ve değiştirilebilir biyolojik ilaçların ruhsatlandırılması için izlenmesi gereken süreçler dünyada farklılıklar göstermektedir. Bu durum kişilerin kaliteli, etkili, güvenli ve ekonomik ilaca erişim hakkını etkilemenin ötesinde hayati tıbbi sonuçlara yol açması açısından da önem taşımaktadır.
Amerikan Gıda ve İlaç Kurumu (FDA, Food and Drug Administration), referans ilaçla etkililik ve güvenlilik açısından farklı olmadığı gösterilen biyobenzerlerin aynı endikasyonda, aynı doz ve sıklıkta referans ilaç yerine kullanılabilmesini “değiştirilebilir” olarak tanımlamaktadır (1). Avrupa İlaç Ajansı’nın (EMA) değiştirilebilirlik tanımı da benzerdir (8). Ancak değiştirilebilirliğe bakış açısı her iki kurum arasında farklılıklar göstermektedir. FDA tarafından 2017’de tartışmaya sunulan ve son hali Mayıs 2019’da yayınlanan değiştirilebilirlik kılavuzuna göre ABD’de “değiştirilebilir” ibaresinin biyobenzer bir ürünün ruhsatına eklenmesi, ancak ruhsat başvurusu yapan firmanın ürettiği biyobenzer molekülün orijinal referans ilaç ile yüksek oranda benzer (parmak izi benzerliği-fingerprint like similarity) olduğunu gösteren klinik öncesi karşılaştırmalı çalışma sonuçları ve karşılaştırılmalı klinik çalışma verilerini sunması sonrası değerlendirilecektir.
FDA, “değiştirilebilir biyobenzer” ruhsat başvurusunda bulunan firmaların değiştirilebilirlik için gerekli kanıtları da dosyalarında iletmelerini beklemektedir. Aşağıdakilerle sınırlı olmamak ve biyolojik ürünün özelliklerine göre farklılıklar gösterebilmekle beraber, bir biyobenzerin “değiştirilebilir” kabul edilebilmesi için ruhsat başvuru dosyasında bulunması beklenen gereklilikler şöyledir:
- Söz konusu biyolojik ürüne ait kritik kalite özelliklerinin tanımlanmış ve analizlerinin tamamlanmış olması
- Referans biyolojik ürünle değiştirilebilir olması beklenen biyobenzer ilaç arasındaki analitik farklılıkların tanımlanması ve bu farklılıkların yaratacağı potansiyel klinik etkinin analizi
- Referans biyolojik ürünün ruhsatlı olduğu her endikasyonda ayrı ayrı biyobenzerin etki mekanizmasının aşağıdakileri içerecek şekilde karşılaştırmalı analizi
- İlgili endikasyonda ilacın etkililiğiyle ilişkili hedef reseptörlerin tanımlanması
- Reseptöre bağlanma afinitesi, doz / konsantrasyon yanıtı ve reseptöre bağlanma sonrası oluşan moleküler sinyal ileti paterninin incelenmesi
- Biyobenzer ürünün moleküler yapısıyla hedef / reseptör etkileşimi arasındaki ilişkinin tetkiki
- Hedef reseptörlerin yerleşimi ve ekspresyon düzeyinin tayini
- Farklı hasta topluluklarında biyobenzer ürünün farmakokinetik ve biyodağılım özelliklerinin incelenmesi
- Farklı hasta topluluklarında biyobenzer ürünün immünojenisite riskinin çalışılmış olması
- Her endikasyon ve hasta popülasyonunda referans ilaca göre toksisitede beklenen farklılıkların (beklenen toksisitelerin ilacın farmakolojik aktivitesiyle ilişkili olup olmadığı gibi veriler dahil olmak üzere) analizi
- Referans ilacın ruhsatlı olduğu her endikasyon veya hasta topluluğunda biyobenzer ürünün kullanımıyla ilişkili etkililik veya güvenliliği etkileyebilecek diğer tüm veriler
Söz konusu veriler sunulurken referans ilaçla yapılan karşılaştırma esnasında ortaya çıkan farklılıklar gerekçelendirilmeli ve olası klinik etkileri hakkında yeterli bilgi ve kanıt iletilmelidir. FDA bazı durumlarda aynı referans ilaç için aynı endikasyonda ruhsatlanmış bir başka biyobenzere ait ruhsat sonrası gerçek yaşam verilerinin değiştirilebilirlik başvurusunda destekleyici materyal olarak kullanılabileceğine dikkat çekmektedir (7).
Değiştirilebilir kabul edilebilmek için biyobenzer ürünlerde yerine getirilmesi beklenen bir başka koşul da referans ilaçtan biyobenzere geçişin (switch) herhangi bir etkililik ya da güvenlilik sorunu oluşturmadığının kanıtlanmasıdır (1,9).
Bu bağlamda FDA bir kişiye bir kereden fazla uygulanacak ilaçlarda “ilaç değiştirme çalışmaları” (switching studies) yapılmasını istemektedir. Söz konusu çalışmalarda referans ilaçtan biyobenzere geçişin (switch) veya referans ilaçla biyobenzerin ardışık değişimlerinin (alterne kullanım) tek başına referans ilaçla yapılan tedaviyle karşılaştırıldığında güvenlilik sorununa ve etkililikte azalmaya neden olmadığının gösterilmesi gereklidir (Şekil 1) (1). Her ürün için çalışma tasarımı, örneklem büyüklüğü, geçişlerin sayısı ve süresiyle çalışmanın sonlanım noktaları yeterli kanıt oluşturacak şekilde seçilmelidir. İlaç değiştirme çalışmalarının “değiştirilebilirlik” açısından yeterli kanıt oluşturabilmesi için uygun koşullarda bazı noktaların dikkate alınmış olması beklenmektedir. FDA tarafından yayınlanan kılavuza göre İlaç Değiştirme Çalışmaları (1,10-12):
- Referans ilaç ABD’de ruhsatlı bir ürün olmalı,
- Randomize, kontrollü ve açık etiketli olmayacak şekilde tasarlanmış olmalı,
- Çapraz geçişli (“cross-over”) ve/veya paralel tasarlanmış olmalı,
- Çalışma sürecinde referans ilaçla biyobenzeri arasında birden fazla ardışık ilaç değişim dönemleri içermeli (Şekil 1),
- Çapraz geçiş dönemleri bir önceki üründen arınma süresi (washout period) dikkate alınarak hesaplanmış olmalı (en az 3 yarılanma ömrüne denk gelen süreden daha fazla olmalı),
- Uygun kontrol grubu bulunmalı,
- Tüm aşamalarda etkililik, güvenlilik ve immünojenisite değerlendirmelerini içermelidir.
Ruhsat başvurusunda bulunan firmanın tek bir çalışma içinde hem biyobenzerliği gösterip hem de biyobenzerin değiştirilebilirliğini kanıtlamak istemesi halinde gücü iyi hesaplanmış, yeterli sayıda örnekleme sahip iki bölümlü bir randomize çalışma düzeni oluşturulması beklenmektedir. İlk bölümde biyobenzer ürünün referans ilaçtan etkililik ve güvenlilik açısından farklı olmadığının gösterilmesini takiben ikinci bölümde ilaç değiştirmenin sonuçları incelenmelidir (1).
Genellikle etkisizlik, yan etki, tedaviye uyum sorunu ve maliyet gibi etkenlerin hekimlerin mevcut tedavilerini ve kullandıkları ilacı değiştirme kararında etkili olduğu
Şekil 1. İlaç Değiştirme Çalışmaları (Switching Studies)
gösterilmiştir; ancak etkililik ve immünojenisiteyle ilgili endişeler özellikle biyolojik ilaçlarla deneyimi olan hekimlerde ilacın değiştirilebilirliği konusunda kararsızlıklara yol açmaktadır (13,14). Avrupa İlaç Ajansı’nın aksine, yukarıda da belirtildiği gibi, FDA biyolojik ürünlere daha baştan, bir takım ek kanıtlar (ilaç değiştirme çalışmaları) sunmaları koşuluyla “değiştirilebilir biyobenzer” ruhsatı düzenlenebilmesi yolunu açmış ve bu yolla hekimlerin endişe duymadan ilaç seçebilmelerini kolaylaştırmaya çalışmıştır.
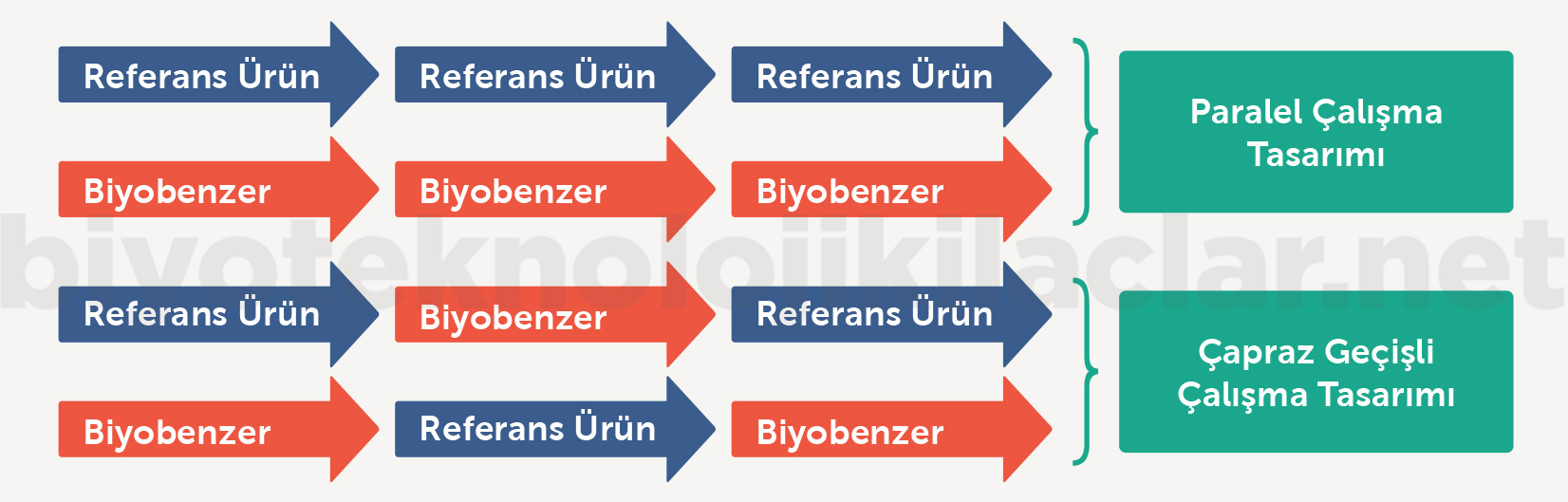
Örnek olarak, ABD’de değiştirilebilir biyobenzer olabilmek için “filgrastim biyobenzer” ruhsat başvurusunda kullanmak üzere yapılan, kemoterapi alan 218 meme kanseri hastasının 4 kola 1:1:1:1 oranında randomize edildiği ve referans ilaç ile biyobenzer ürünün tedavi süresince gelişen ortalama ağır nötropeni süresi üzerinden karşılaştırıldığı randomize, çift kör, kontrollü, çok merkezli PIONEER çalışması ele alınabilir (15). Bu çalışmayla etkililik, güvenlilik ve immünojenisite açısından iki ürünün birbirinden farklı olmadığı klinik olarak kanıtlanmıştır. 2018 yılında yayınlanan PINONEER çalışmasının bir alt analizinde (“switching study”) ise birden çok kez yapılan referans ilaç – biyobenzer değişiminin etkililik, güvenlilik ve immünojenisite açısından klinik olarak anlamlı bir fark yaratmadığı gösterilmiştir (16). Şekil 2’de çalışmanın tasarımı sunulmuştur.
Şekil 1. İlaç Değiştirme Çalışmaları (Switching Studies)
EMA, FDA’dan farklı olarak değiştirilebilirlik konusuna müdahale etmemiş ve mevcut kanıtlar doğrultusunda bir biyobenzerin değiştirilip değiştirilemeyeceğinin kararını üye ülkelerin sağlık otoritelerine bırakmıştır (17). EMA, küçük biyolojik moleküller için özellikle rekombinant G-CSF gibi etki mekanizmaları tek bir bölge üzerinden gerçekleşen proteinlerde fizikokimyasal karakterizasyon, biyolojik aktivite ve klinik farmakokinetik / farmakodinamik karşılaştırmalı çalışmalarla yüksek oranda benzerlik gösterilmiş olması koşuluyla ayrıca klinik etkililik ve güvenlilik için randomize kontrollü bir Faz III çalışma yapılmasını gerekli görmemektedir (18). Erken klinik çalışmalarda tespit edilen yan etki, immünojenisite ve etkililik verilerinin ruhsatlanma aşaması için yeterli olduğu görüşündedir. Bu nedenle, EMA’ya sunulan veriler üzerinden değiştirilebilirlik konusunda bir kanaat oluşturma imkanı küçük biyolojik moleküller için sınırlı olabilir.
EMA’ya benzer şekilde Dünya Sağlık Örgütü’nün çıkardığı Biyobenzer Kılavuzu’nda ülkelere göre değişiklik gösterebileceğinden değiştirilebilirlik, eczane ikamesi, ilaç değişimi için gereklilikler gibi konular kapsam dışı bırakılmıştır (19).
Türkiye biyobenzerlerin değerlendirilmesi ve ruhsatlandırılmasında ortaya çıkabilecek sorunları erken fark eden ülkelerden biri olarak, 2008 yılında büyük oranda EMA’nın yaklaşımını benimseyerek bir biyobenzer kılavuzu oluşturmuş daha sonra son gelişmeler ve ülkenin gereksinimleri ışığında 2017 yılında bu kılavuzu gözden geçirerek güncellemiştir (20). Güncellenmiş kılavuz taslağı Türkiye İlaç ve Tıbbi Cihaz Kurumu tarafından web sayfasından erişilebilir durumda olmakla beraber, henüz son hali verilmemiş ve kullanıma girmemiştir. Söz konusu taslakta değiştirilebilirlikle ilgili maddeler bulunmamaktadır.
Değiştirilebilirlik konusunun özellikle monoklonal antikorlar gibi büyük biyolojik moleküller için daha önemli olabileceği düşünülmektedir. Gerek küçük gerekse büyük moleküler yapıdaki biyobenzerlerle referans biyolojikler arasında hematolojik / onkolojik endikasyonlarda yapılmış önemli ilaç değiştirme çalışmalarına literatürde rastlanmamıştır. Biyobenzerlerle yapılan çoğunluğu romatolojik ve nefrolojik hastalıklarda kullanılan biyobenzerlerin retrospektif gerçek yaşam verilerinden oluşan yakın tarihli bir sistematik derlemede biyobenzerlere geçişin immünojenisite veya genel yan etki profilini değiştirmediği ve etkililik yönünden bir farklılığa yol açmadığı tespiti yapılmıştır (21). Ancak, bu derleme ilaç değişiminin biyobenzerlerle yapılan tedavilerin klinik sonuçlarını yansıtmadığı iddiasıyla eleştirilmektedir (22).
Değiştirilebilirlik konusu özellikle, biyobenzerler konusunda yeterli kanun ve mevzuatın bulunmadığı ülkelerde ciddi sağlık sorunlarına neden olabilir. Yapılan ayrıntılı preklinik ve klinik çalışmalarla yüksek düzeyde benzerlik gösterilen biyolojikler arasında oluşturulan kanıtlar üzerinden değiştirilebilirlik tartışması yapılması nispeten daha kolay olabilirken mevzuatın yeterli olmadığı ülkelerde bu boşluktan yararlanılarak jenerik benzeri düzenlemelerle ruhsatlanan biyolojik ilaçlarla tedavinin faturası ağır olabilir.
Bu durum, örneğin Gaucher hastalığı gibi klinik tedavi sonuçlarının aylar, yıllar içinde ölçülebildiği durumlarda daha da önem kazanmaktadır. Nitekim Güney Amerika’da biyobenzer ve değiştirilebilir olduğu gösterilmemiş, karşılaştırmalı yeterli çalışması olmayan ve yapılan analizlerde terminal glikolizasyonu farklı olduğu için doku penetrasyonunun optimal olmayacağı gösterilmiş bir imigluseraz molekülü biyobenzer ruhsatı almıştır ve orijinal ürünün kısa ürün bilgisi kullanılarak piyasaya sürülmüştür.
Bu ilacı kullanan hastalarda orijinal imigluserazdan geçiş yapıldığı için etkililik verilerini görmek yıllar alabilir. Moleküler yapısı nedeniyle etkili olması beklenmeyen bu karşılaştırmalı çalışması olmayan biyobenzerle artmış advers etki bildirimleri olmuştur. Ancak bu ürünün orijinal ürünle aynı INN’yi kullanıyor olması nedeniyle yapılan bildirimlerden sağlıklı farmakovijilans verileri oluşturmak mümkün olmamaktadır. Advers etkinin orijinal imigluseraza mı yoksa karşılaştırmalı çalışması olmayan biyobenzerine mi ait olduğu her olguda ayırt edilememektedir.
Bu örnekten de anlaşılacağı gibi biyolojikler ve biyobenzerleri arasında kanıt bütünlüğü oluşturacak şekilde yüksek derece benzerlik oluğunu gösteren karşılaştırmalı preklinik ve klinik sağlam veriler olmaksızın referans ilaçla biyobenzeri arasında değişim yapmak doğru görünmemektedir. Bu konuda maliyetli olmasına karşın FDA’nın izlediği yol en azından sık rastlanan hastalıkların tedavilerinde kullanılan biyobenzerlerin ruhsatlandırılmasında en güvenilir yol gibi görünmektedir. Nadir hastalıklarda kullanılmak üzere geliştirilen biyobenzerlerde değiştirilebilirlik kararını karşılaştırmalı preklinik ve erken klinik çalışmaların sonuçları belirleyebilir. Değiştirilebilir kabul edilen biyobenzerlerin farmakovijilansı ve gerçek yaşam verileri söz konusu kararın netleşmesinde yardımcı olacaktır.