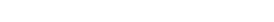İÇİNDEKİLER
- Önsöz
- Giriş
- Biyoteknolojik İlaçlar ve Üretim Süreçleri
- Biyobenzer İlaçlar ve Karşılaştırılabilirlik
- Biyobenzer Ürünlerde Ekstrapolasyon
- Biyobenzer İlaçlarda Değiştirilebilirlik
- Biyoüstünler
- Referans Ürünle Yeterli Karşılaştırma Çalışması Olmayan Biyolojik Ürünler
- Biyolojik ve Biyobenzer İlaçlarda Farmakovijilans, İzlenebilirlik ve Risk Yönetimi
- Yazarlar
BİYOTEKNOLOJİK İLAÇLAR
Biyoteknoloji ve moleküler biyolojideki gelişmeler sayesinde hastalıkların genetik temelleri aydınlatılmaya başlanmış, biyolojik olarak aktif proteinleri kodlayan genlerin tespit edilmesi sağlanmıştır. Eksik gen ürünlerinin yerine konulması, gen tedavisi yöntemiyle fonksiyonel bir veya birkaç genin hastaya nakledilmesi veya biyolojik / biyoteknolojik ilaçların hastaya verilmesiyle mümkün olabilmektedir.
Biyoteknolojik ilaçlar, rekombinant DNA teknolojisi kullanılarak canlı organizmalarda üretilen makromoleküller olup; ulusal ve uluslararası kılavuzlarda biyolojik ilaç kapsamında değerlendirilir (7). Biyofarmasötikler olarak da adlandırılan biyoteknolojik ilaçlar, sitokinler, enzimler, hormonlar, pıhtılaşma faktörleri, aşılar, monoklonal antikorlar, hücresel tedavi ürünleri, antisens oligonükleotitler ve peptit terapötikler olarak gruplandırılabilir. Sentetik peptitler yapıları nedeniyle kimyasal ilaçlar ve biyolojik ilaçlar arasında yer alır (8,9).
Biyoteknolojik ilaçlar kimyasal ilaçlardan farklılıklar gösterir. Biyoteknolojik ilaçların kimyasal ilaçlardan farklılıkları Tablo 2’de verilmiştir (9-12).
Tablo 2. Biyoteknolojik ilaçlar ile kimyasal ilaçlar arasındaki farklar
Biyolojik ürünler Amerika Birleşik Devletleri Gıda ve İlaç Kurumu (U.S. Food and Drug Administration, FDA), Avrupa İlaç Kurumu (European Medicine Agency, EMA) ve Türkiye İlaç ve Tıbbi Cihaz Kurumu (TİTCK) tarafından aşağıdaki şekillerde tanımlanmıştır.
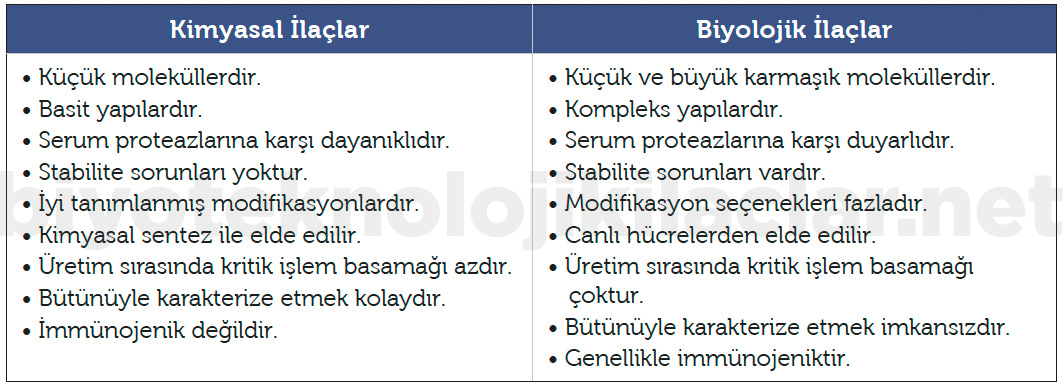
FDA Halk Sağlığı Hizmeti Yasası’na göre (Bölüm 351) biyolojik ürün; bir hastalığı önlemek veya tedavi etmek üzere uygulanabilen virüs, terapötik serum, toksin, antitoksin, aşı, kan, kan ürünleri veya türevleri, alerjen ürün, protein (kimyasal olarak sentezlenen polipeptitler hariç) veya analog ürünlerdir. Biyolojik ürünler FDA’da ‘İlaç Değerlendirme ve Araştırma Merkezi’ (CDER) ve ‘Biyolojik Ürünler Değerlendirme ve Araştırma Merkezi’ (CBER) olmak üzere iki merkez tarafından değerlendirilmektedir (13). FDA’da CBER ve CDER kapsamında değerlendirilen biyolojik ürünler Tablo 3’te belirtilmiştir (14,15).
Tablo 3. FDA’da CBER ve CDER kapsamında değerlendirilen biyolojik ürünler
Biyolojik ilaç EMA tarafından; etkin maddesi biyolojik olan bir ürün olarak tanımlanmıştır (16). Biyolojik ürünler aşağıdaki şekilde sınıflandırılmıştır:
- İmmünolojik ürünler
- Kan ürünleri
- Rekombinant DNA teknolojisi ürünleri, hibridoma ve monoklonal antikor yöntemleri ile elde edilen ürünler
- İleri tedavi tıbbi ürünleri
- Etkin maddenin doğrudan kendisinden türetilmediği reaktifler
Ülkemizde ise 19/01/2005 tarihli ve 25705 sayılı Resmi Gazete’de yayımlanan “Beşeri Tıbbi Ürünler Ruhsatlandırma Yönetmeliği”nin 2. Bölümü “Özel Ruhsat Dosyaları ve Şartları” Kısmının 4. Maddesi "Benzer Biyolojik Tıbbi Farmasötik Ürünlerin ruhsatlandırma kriterlerini" belirlemek amacıyla hazırlanan “Biyobenzer Tıbbi Ürünlere İlişkin Kılavuz” 07.08.2008 tarihli ve 5285 sayılı Bakan Olur’u ile yürürlüğe konulmuştur.
Bu kılavuzda biyolojik ilaç tanımı yukarıda yer alan EMA tarafından yapılan tanım ile aynıdır.
TİTCK tarafından 2017 yılında güncelleme çalışmaları başlatılan ve halen devam eden “Biyobenzer Tıbbi Ürünler Hakkında Kılavuz” taslağında, biyolojik tıbbi ürün ‘etkin madde veya maddeleri biyolojik bir kaynakta üretilen ya da biyolojik bir kaynaktan saflaştırılan, kalitesi, imalat süreci ve kontrolleri fizikokimyasal ve biyolojik testler ile birlikte gösterilen beşeri tıbbi ürün’ olarak tanımlanmıştır (17).
KAYNAKLAR